Software como Dispositivos Médicos SaMD): descripción general
El software como Dispositivos Médicos SaMD) es el tema de mayor auge en el sector sanitario. Se prevé que el SaMD crezca a una tasa de crecimiento anual compuesta (CAGR) del 10,78 % a nivel mundial. Este crecimiento se debe a diversos factores, como la adopción del Internet de las cosas (IoT), las plataformas sanitarias digitales y la adopción de software para la monitorización continua de parámetros fisiológicos por parte de los proveedores de asistencia sanitaria para la asistencia remota. Sin embargo, este panorama prometedor también presenta retos únicos, uno de los cuales es determinar si entra dentro de la Dispositivos Médicos y cumple con los requisitos reglamentarios.
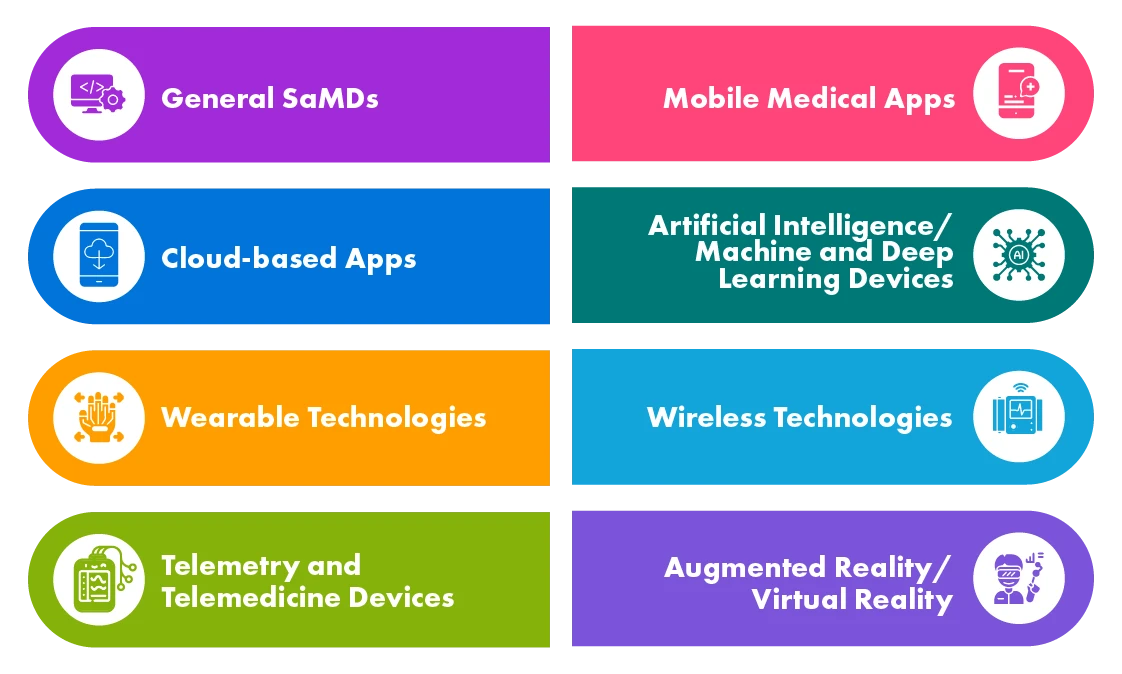
Diferentes tipos de productos sanitarios digitales
Escenario normativo global para el registro del software como Dispositivos Médicos SaMD)
Los SaMD se utilizan en diversas aplicaciones, como el cribado y el diagnóstico, la monitorización y la alerta, la gestión de enfermedades, etc. Las agencias sanitarias de los países desarrollados, como la UE, US, Canadá y Australia, han definido normativas en torno a los SaMD y algunas de ellas ya han elaborado documentos de orientación, mientras que otras están en proceso de hacerlo.
Algunos mercados regulados y no regulados consideran el software como dispositivos médicos, pero no cuentan con directrices diferenciadas y específicas para la clasificación del software como Dispositivos Médicos SaMD). Siguen las directrices armonizadas aceptadas internacionalmente para la evaluación y aprobación del software.
A continuación se enumeran algunas de las directrices más destacadas disponibles sobre el registro de software como Dispositivos Médicos SaMD):
- Orientaciones del IMDRF para la clasificación, el Quality Management System (QMS), la evaluación de la ciberseguridad y la evaluación clínica.
- El EU MDR 2017/745 de EU MDR ha detallado los requisitos reglamentarios y las orientaciones para esta categoría de dispositivos.
- Las directrices del MDCG sobre la cualificación y clasificación de los SaMD, los requisitos de los Clinical Evaluation Reports (CER)/Informes de Evaluación del Rendimiento (PER) para SaMD.
- FDA US sobre ciberseguridad, evaluación clínica y requisitos de registro para diferentes tipos de software, como sistemas de decisión, sistemas de archivo y comunicación de imágenes (PACS), aplicaciones móviles, etc.
- Documento de orientación del Health Canada sobre la definición y clasificación SaMD .
- Nueva normativa de la TGA sobre productos sanitarios basados en software.
El registro de SaMD en otros mercados mundiales se gestionará caso por caso y requiere una estrecha interacción con la Agencia de Salud respectiva para su aprobación. La vía general seguida para el registro de SaMD incluye:
- Determinar si un programa informático determinado puede considerarse un SaMD.
- Clasificación de los dispositivos en función del riesgo.
- Identificar las normas aplicables y los datos requeridos por la Agencia Sanitaria correspondiente.
- Generar los datos requeridos por la Agencia correspondiente.
- Compilación del expediente técnico según los requisitos del país.
- Presentación y resolución de consultas hasta su aprobación.
- Gestión del ciclo de vida posterior a la homologación.
Nuestras competencias
- Regulatory Intelligence Services (relacionados con el mercado y el etiquetado)
- Diligencia debida reglamentaria / Informes estratégicos
- Calificación y clasificación de SaMD
- Clasificación del producto Aplicación a NB
- Análisis de Brechas
- Reuniones previas a la presentación con FDA
- Identificación de las normas aplicables
- Actividades de gestión de riesgos
- Apoyo a la gestión de riesgos
- Apoyo al etiquetado
- Creación/revisión/actualización de procedimientos/plantillas específicos SaMD
- UDI/ GUDID
- Registro de productos (registro de software)
- Registro de establecimientos
- Lista de dispositivos
- Respuesta de consulta HA-Servicios SaMD
¿Por qué Freyr?
Preguntas más frecuentes (FAQ)
La regulación del software médico está supervisada por varios organismos reguladores mundiales, como FDA en Estados Unidos, EMA en Europa y la PMDA en Japón. Estos organismos clasifican el software médico en función del riesgo y establecen directrices de seguridad, calidad y eficacia. Se exige el cumplimiento de las normas ISO, como ISO 13485 y 62304.
Para determinar la clasificación de riesgo del software como Dispositivos Médicos SaMD) hay que evaluar factores como el uso previsto y el daño potencial. Los SaMD se clasifican como Dispositivos Médicos tradicionales Dispositivos Médicos de la importancia de la información proporcionada para la toma de decisiones sanitarias y el estado de la situación o condición sanitaria como no grave, grave y crítica. Las directrices reglamentarias y la consulta a expertos son fundamentales en este proceso, ya que garantizan el cumplimiento de la normativa y la seguridad de los pacientes.
SaMD al software destinado a ser utilizado para uno o más fines médicos, sin formar parte de un Dispositivos Médicos físico. Funciona en plataformas informáticas de uso general, como teléfonos inteligentes, tabletas u ordenadores personales. Por otro lado, SiMD es un software que forma parte integrante de un Dispositivos Médicos físico, contribuyendo a su funcionalidad y rendimiento. SiMD no puede utilizarse de forma independiente y depende de los Dispositivos Médicos asociados Dispositivos Médicos cumplir su finalidad prevista.
Un software que está integrado como parte de un Dispositivos Médicos que es necesario para alcanzar el objetivo médico previsto NO se considera un SaMD.
El plazo para lograr la conformidad con SaMD depende de la clase de riesgo y de los requisitos normativos. Sin embargo, con la asistencia reglamentaria adecuada puede garantizar un proceso de cumplimiento más fluido con riesgos mínimos.
Dispositivos Médicos
- Estrategia reguladora global para las enfermedades animales asintomáticas.
- Apoyo normativo y de inteligencia de mercado.
- Servicios de clasificación y registro de productos para SaMD.
- Apoyo normativo para los documentos de desarrollo de productos SaMD .
- Servicios de consulta sobre estudios de evaluación clínica SaMD .
- Gestión de cambios tras la aprobación.
- Servicio de representación local.

- Estrategia reguladora global para las enfermedades animales asintomáticas.
- Apoyo normativo y de inteligencia de mercado.
- Servicios de clasificación y registro de productos para SaMD.
- Apoyo normativo para los documentos de desarrollo de productos SaMD .
- Servicios de consulta sobre estudios de evaluación clínica SaMD .
- Gestión de cambios tras la aprobación.
- Servicio de representación local.