Evaluación del funcionamiento de los productos sanitarios - Panorama general
El mercado del software como Dispositivos Médicos SaMD) está experimentando un auge a nivel mundial debido a factores como el aumento de la demanda de servicios de salud a distancia y las próximas innovaciones en el ámbito de la salud digital. En Europa, se prevé que el SaMD crezca aproximadamente un 27,1 % durante el periodo 2021-2027.
SaMD los Dispositivos Médicos para diagnóstico in vitro (IVD). Es fundamental destacar que la normativa de la UE no utiliza el término «software como Dispositivos Médicos SaMD)», sino que emplea el términoDispositivos Médicos », abreviado como MDSW.
En la Unión Europea (UE), los MDSW se rigen por el Dispositivos Médicos (MDR) 2017/745 y el Reglamento sobre productos sanitarios para diagnóstico in vitro (IVDR) 2017/746. Estos reglamentos proporcionan un marco para garantizar la seguridad y el rendimiento de los productos sanitarios, incluidos los SaMD, en el mercado de la UE.
¿Cómo se clasifica el software como Dispositivos Médicos?
Para determinar si su dispositivo es considerado SaMD la UE, debe evaluar si el software está destinado a ser utilizado para uno (01) o más fines médicos sin formar parte de un Dispositivos Médicos de hardware. Si su software funciona de forma independiente para cumplir un fin médico, podría calificarse como SaMD.
Sin embargo, si está destinado a controlar un Dispositivos Médicos físico Dispositivos Médicos forma parte integrante de uno, no se consideraría un software independiente y, por lo tanto, no sería SaMD. Asegúrese siempre de que su producto cumpla con las últimas normativas y directrices de la UE para dispositivos médicos.
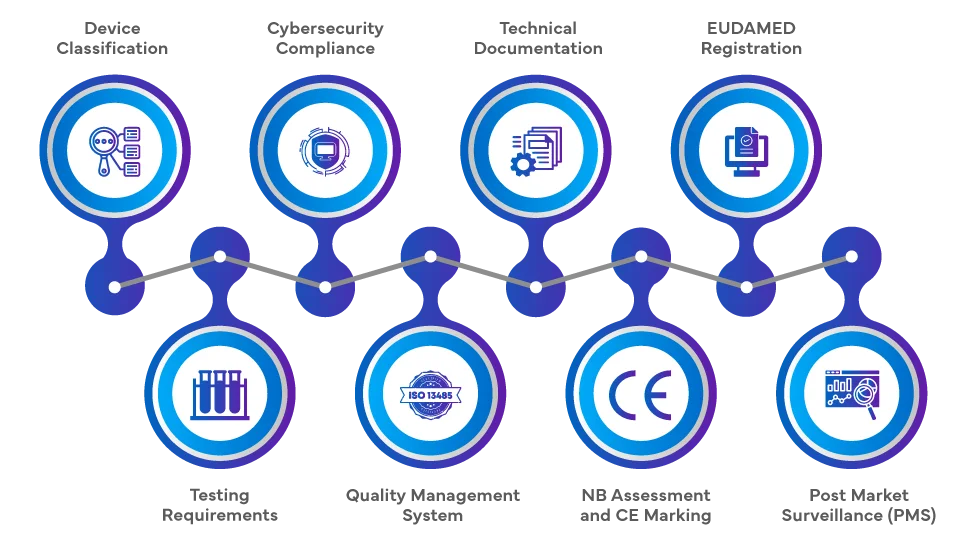
¿Cómo registrar su SaMD en la UE?
El proceso normativo para introducir SaMD el mercado de la UE en virtud del EU MDR y EU MDR IVDR 2017/746 EU MDR implica una serie de pasos exhaustivos. Los fabricantes deben clasificar el producto de software en función de su finalidad y nivel de riesgo, seguido de una evaluación de conformidad, en la que puede intervenir un organismo notificado (ON) para las clases de mayor riesgo. La documentación técnica, la evaluación clínica y el cumplimiento de los sistemas de gestión de la calidad (SGC) son fundamentales. Una vez superada la evaluación, se coloca el marcado CE y es necesario registrarse en la Base de Datos Europea de Productos Sanitarios (EUDAMED). Post-market Surveillance (PMS) continua Post-market Surveillance (PMS), la vigilancia y el cumplimiento de los requisitos de ciberseguridad completan el proceso normativo.
Preguntas más frecuentes (FAQ)
Un certificado EU MDR es un documento expedido por un organismo notificado designado como resultado de una evaluación de conformidad con el Dispositivos Médicos (EU MDR ) o el Reglamento sobre productos sanitarios para diagnóstico in vitro (IVDR) 2017/746 de la Unión Europea. Este certificado verifica que un Dispositivos Médicos los requisitos establecidos en el EU MDR, que incluyen normas de seguridad, rendimiento y calidad. El certificado es necesario para que los productos sanitarios y los productos para diagnóstico in vitro puedan comercializarse legalmente en la UE.
En la UE, los productos sanitarios se clasifican en cuatro (04) clases de riesgo: Clase I, Clase IIa, Clase IIb y Clase III. La Clase I representa los productos con el menor riesgo, y la Clase III incluye los productos con el mayor riesgo. La clasificación tiene en cuenta factores como la invasividad del producto, la duración del uso, la parte del cuerpo afectada y los riesgos potenciales asociados al diseño técnico y la fabricación del producto.
Del mismo modo, SaMD también se clasifica en función del riesgo que supone para los pacientes y los usuarios, yendo de bajo riesgo (Clase I) a alto riesgo (Clase III).
El término «Software como Dispositivos Médicos SaMD)» se aplica cuando el software está diseñado para uno (01) o más fines médicos, realizando estas funciones de forma independiente sin ser parte integrante de un Dispositivos Médicos de hardware. Por otro lado, «Software en un Dispositivos Médicos SiMD)» se utiliza cuando el software está integrado en un equipo médico, lo que se conoce como software integrado o firmware.
Es fundamental destacar que la normativa de la UE no utiliza el término «Software como Dispositivos Médicos», sino que emplea el términoDispositivos Médicos », abreviado como MDSW.
Dispositivos Médicos (MDSW)» se refiere al software destinado a ser utilizado, ya sea por sí solo o en combinación, para un fin descrito en la definición deDispositivos Médicos según el Reglamento EU MDR y el Reglamento (UE) 2017/746 sobre productos sanitarios para diagnóstico in vitro (IVDR).
El tiempo que se tarda en homologar un SaMD en la UE puede variar considerablemente en función de varios factores. Los principales determinantes son la clasificación del dispositivo, su complejidad, la ruta de evaluación de la conformidad, la participación de un organismo notificado y la eficiencia del proceso de presentación de la normativa.
Registro SaMD en otros mercados (UE/Australia/Corea) para productos sanitarios
- Estrategia global EU MDR en materia de reglamentación EU MDR para las SaMD.
- Apoyo normativo y de inteligencia de mercado.
- Servicios de clasificación y registro de productos para SaMD.
- Apoyo normativo para los documentos de desarrollo de productos SaMD .
- Servicios de consulta sobre estudios de evaluación clínica SaMD .
- Gestión de cambios tras la aprobación.
- Servicios EAR/UKRP/CH-Rep.

- Presentaciones con éxito de varias clases de SaMD.
- Personal dedicado y experto para proporcionar apoyo normativo.
- Presentación puntual de los resultados.
- Acceso de afiliados locales para responder a los retos de Health Authority (HA) y a los requisitos específicos de cada idioma.
- Apoyo en el país o Representante Legal (RL), con un modelo rentable.
- Servicios de gestión de recursos reglamentarios/aumento de personal.





