La publicité directe aux consommateurs (DTC) pour les médicaments est devenue un sujet de discussion privilégié ces dernières années. Ces publicités, qui s'adressent aux consommateurs plutôt qu'aux professionnels de la santé, ont eu le mérite de sensibiliser les patients et d'accroître la demande de certains médicaments. Toutefois, elles ont également été critiquées parce qu'elles pourraient conduire à des surdiagnostics et à des surtraitements.
Participant à la tendance actuelle des entreprises pharmaceutiques, les dépenses totales en marketing sont connues pour être supérieures à leur budget de recherche. À l'échelle mondiale, 1,42 billion de dollars ont été dépensés en marketing. Aux États-Unis, 486,62 milliards de dollars ont été dépensés en 2021 pour commercialiser des médicaments auprès des médecins ; au Canada, 29 305,1 millions de dollars ont été dépensés en 2022. Lorsque ces chiffres ont été ventilés, 56 % correspondaient à des échantillons gratuits, 25 % à des représentants commerciaux pharmaceutiques « détaillant » (promouvant directement les médicaments auprès des) médecins, 12,5 % à de la publicité directe auprès des utilisateurs, 4 % à des détails fournis aux hôpitaux et 2 % à des publicités dans des revues2. Parfois, les pratiques de marketing négatives peuvent affecter à la fois les patients et les professionnels de la santé.
Types de campagnes de promotion des médicaments
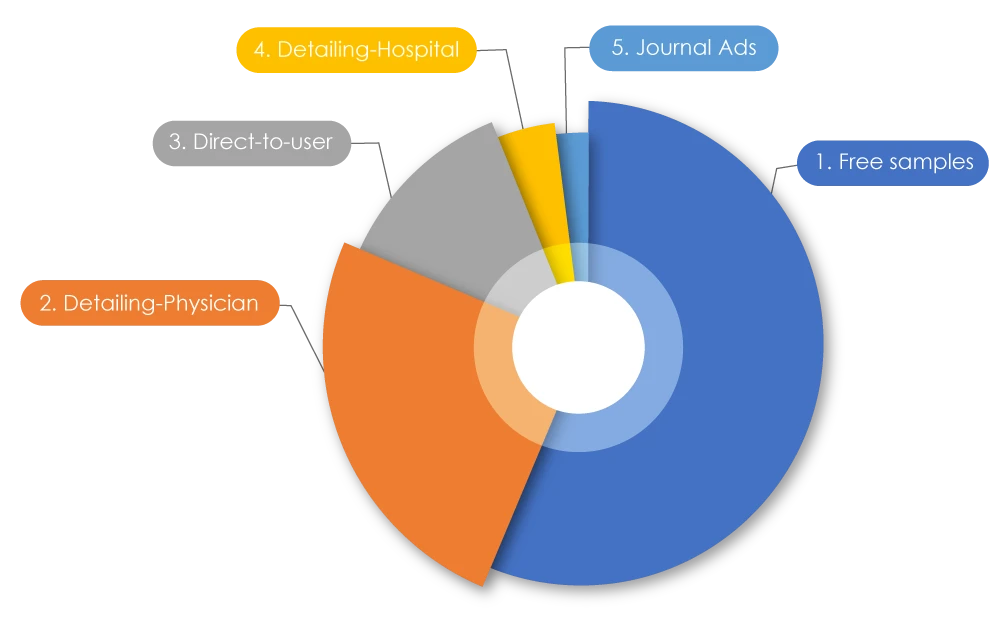
Source : Marketing pharmaceutique - Wikiwand
Publicité pharmaceutique auprès du grand public
Des restrictions sont imposées à la publicité pour les médicaments de prescription auprès du grand public, également appelée publicité directe auprès du consommateur (DTC). Pour promouvoir des médicaments de prescription auprès du public, la communication doit répondre à certaines exigences fondamentales :
- La cohérence de la publicité et de la promotion des médicaments sur ordonnance avec leur étiquetage repose sur l'usage prévu pour lequel le produit est approuvé par la FDA l'étiquetage du médicament FDA). L'étiquetage fournit des informations sur la manière d'utiliser le produit de manière sûre et efficace pour l'indication approuvée. La publicité et la promotion qui ne sont pas conformes à l'étiquetage FDA sont considérées comme des promotions « hors étiquetage » illégales.
- La promotion et la publicité pour les médicaments de prescription exigent un juste équilibre entre les avantages et les risques des produits, en veillant à ce que ces informations soient comparables en termes de profondeur, de détail et de contexte.
- Les allégations doivent être étayées par des preuves ou une expérience clinique suffisantes.
- Véracité et absence de tromperie - Si la publicité et la promotion d'un médicament de prescription sont fausses ou trompeuses, elles seront considérées comme des erreurs de marquage au sens de la loi fédérale sur les aliments, les médicaments et les cosmétiques (Federal Food, Drug, and Cosmetic Act - FDCA) et feront l'objet d'une mise en œuvre.
- L'utilisation d'un langage adapté au consommateur, en évitant l'utilisation d'un langage technique, de termes scientifiques et de jargon médical dans la publicité et la promotion destinées aux consommateurs. Elle doit être conforme à l'étiquetage ou à la monographie approuvés du produit.
Informations contenues dans la publicité pharmaceutique destinée au grand public
La publicité et la promotion des médicaments sur ordonnance destinées aux consommateurs doivent contenir les éléments essentiels suivants, conformément aux réglementations de la FDCA et de la Food and Drug Administration (FDA).
- Les noms exclusifs et établis doivent être conformes aux FDA
- Elle doit indiquer la quantité d'ingrédients contenus dans le médicament faisant l'objet de la publicité
- Elle doit inclure un "bref résumé" qui divulgue chaque effet secondaire, avertissement, précaution et contre-indication. Elle est principalement axée sur les informations importantes relatives aux risques plutôt que sur une liste exhaustive des risques liés au produit. La plupart des risques sont présentés d'une manière susceptible d'être comprise par les consommateurs.
- Les risques majeurs liés aux produits doivent être présentés de manière claire, visible et neutre sous la forme d'une "déclaration majeure"
- Les déclarations d'information sur les effets indésirables pour les publicités DTC doivent inclure la mention MedWatch suivante, imprimée en caractères bien visibles : « Vous êtes encouragé à signaler les effets secondaires négatifs des médicaments sur ordonnance à la FDA. Consultez fda ou appelez le +1–800-FDA-1088FDA
- Les étiquettes et publicités de rappel sont exemptées des exigences générales. Il est important de noter que les étiquettes et publicités de rappel ne sont pas autorisées pour les médicaments sur ordonnance dont l'étiquetage FDA comporte une mise en garde encadrée.
Pour la publicité des médicaments en vente libre, contactez Us
Pour la publicité directe sur les médicaments
Restrictions sur les interactions entre les patients ou les organisations de patients et l'industrie
Les interactions entre les entreprises pharmaceutiques et les patients/associations de patients ne sont autorisées que dans quelques pays, comme les États-Unis, mais avec des limitations, telles que :
- Doit être inscrit sur l'étiquette/CFL
- Équilibré
- Suffisamment étayé et
- Ne sont pas autrement fausses ou trompeuses
En outre, les interactions avec les clients ne doivent pas impliquer la loi anti-corruption en incitant les associations de patients ou les patients à recommander ou à utiliser le produit annoncé.
Au Royaume-Uni, la publicité des DTC auprès du public est autorisée pour les produits pharmaceutiques, mais exclut les enfants. La publicité pour les médicaments délivrés uniquement sur ordonnance est interdite. Les publicités doivent mentionner le nom du produit et le nom de l'ingrédient actif. Les échantillons de produits ou les bons permettant aux consommateurs d'obtenir le produit gratuitement ou à un prix déraisonnablement bas ne sont pas autorisés.
En Allemagne, la publicité destinée au grand public est autorisée uniquement pour les médicaments destinés aux enfants de moins de 14 ans. La publicité destinée au grand public pour les médicaments délivrés uniquement sur ordonnance est interdite. Il existe toutefois des règles spéciales pour la publicité des Produits médicaux des cercles professionnels. Ces règles spéciales sont principalement énoncées dans la loi sur la publicité pour les médicaments (Heilmittelwerbegesetz, « HWG ») et ont été modifiées par la loi allemande sur les médicaments (Arzneimittelgesetz – « AMG ») afin d'être conformes à la directive 2001/83/CE4.
Débat sur la possibilité de faire de la publicité pour les médicaments à Era numérique
Les partisans de la publicité directe pour les médicaments affirment qu'elle responsabilise les patients en leur fournissant des informations sur les options thérapeutiques. Ils soulignent également qu'elle peut entraîner une augmentation de la demande de médicaments, ce qui peut être bénéfique pour les sociétés pharmaceutiques.
D'autre part, les détracteurs de la publicité directe pour les médicaments affirment qu'elle peut conduire à des surdiagnostics et à des surtraitements. Ils affirment que ces publicités exagèrent souvent les avantages des médicaments tout en minimisant leurs risques, ce qui conduit les patients à demander à leur médecin des médicaments dont ils n'ont peut-être pas besoin. En outre, ils affirment que cela peut entraîner une augmentation des coûts des soins de santé, car les patients peuvent se voir prescrire des médicaments de marque plus coûteux plutôt que des alternatives génériques moins chères.
Malgré le débat en cours, la publicité directe auprès des consommateurs pour les médicaments est là pour rester. La FDA publié des lignes directrices pour ce type de publicité, qui comprennent des exigences en matière de divulgation des risques et d'équilibre équitable entre les avantages et les risques. En conclusion, la publicité directe auprès des consommateurs pour les médicaments a le potentiel d'éduquer les patients et d'augmenter la demande pour certains médicaments. Cependant, il est également important de prendre en compte les inconvénients potentiels et d'être conscient des limites des informations fournies dans ces publicités. Comme toujours, il est important de consulter votre professionnel de santé avant de prendre tout médicament. Reach les experts de Freyr pour end-to-end !