
Zamienność z referencyjnym produktem biologicznym jest kluczowym etapem procesu zatwierdzania leków biopodobnych. Gwarantuje ona, że lek biopodobny może zastąpić produkt referencyjny bez znaczącego ryzyka zmniejszenia skuteczności lub zwiększenia obaw dotyczących bezpieczeństwa. Niniejszy blog stanowi próbę zrozumienia najnowszych FDA dotyczących czynników branych pod uwagę przy ocenie zamienności oraz najlepszych praktyk branżowych w zakresie osiągania doskonałości regulacyjnej.
Definiowanie wymienności
Osiągnięcie zamienności jest złożonym i rygorystycznym procesem, który wymaga spełnienia rygorystycznych wymogów regulacyjnych. Wyzwanie polega na wykazaniu, że produkt biopodobny nie tylko odpowiada produktowi referencyjnemu pod względem bezpieczeństwa i skuteczności ale także zapewnia takie same wyniki kliniczne u każdego pacjenta. Niespełnienie tych wymagań może skutkować opóźnieniami lub odmową zatwierdzenia, wpływając na dostęp do rynku i opiekę nad pacjentami.
Wymogi prawne dotyczące wymienności
W swoich wytycznych FDA konkretne kryteria wykazania zamienności. Kryteria te obejmują:
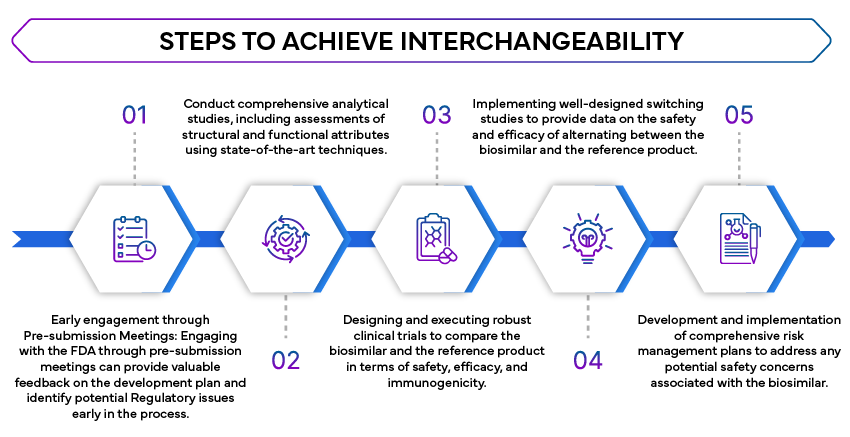
- Porównawcze badania analityczne: Wymagane są szeroko zakrojone badania analityczne w celu wykazania, że produkt biopodobny jest wysoce podobny do produktu referencyjnego. Badania te oceniają strukturę molekularną, funkcję i skład produktu biopodobnego.
- Badania kliniczne: Badania kliniczne są niezbędne do potwierdzenia, że produkt biopodobny nie wykazuje klinicznie istotnych różnic w stosunku do produktu referencyjnego pod względem bezpieczeństwa, czystości i siły działania. Często obejmuje to porównawcze badania farmakokinetyczne (PK) i farmakodynamiczne (PD).
- Badania dotyczące zamiany: FDA badań dotyczących zamiany w celu oceny wpływu zamiany produktu biopodobnego na produkt referencyjny. Badania te mają kluczowe znaczenie dla zapewnienia, że zamiana nie wpływa na skuteczność ani bezpieczeństwo leczenia.
- Ocena ryzyka i strategie ograniczania ryzyka (REMS): W stosownych przypadkach należy uwzględnić REMS, aby zapewnić, że lek biopodobny może być stosowany zamiennie bez dodatkowych obaw o bezpieczeństwo.
Kroki do strategicznego osiągnięcia wymienności
Rola partnera regulacyjnego
Partnerstwa regulacyjne mogą znacznie zwiększyć prawdopodobieństwo osiągnięcia wymienności. Oto, w jaki sposób partner regulacyjny może pomóc:
- Porady ekspertów: Zapewnia fachowe doradztwo w zakresie wymogów regulacyjnych i strategii zgodnych z FDA .
- Wsparcie w zakresie dokumentacji: Pomoc w przygotowaniu wysokiej jakości dokumentów aplikacyjnych zgodnych ze standardami regulacyjnymi.
- Projektowanie badań klinicznych: Wspiera projektowanie i przeprowadzanie solidnych badań klinicznych i przełączeniowych.
- Interakcje z działem kadr: Ułatwia skuteczną komunikację z HA, zapewniając terminowe i konstruktywne informacje zwrotne.
- Zarządzanie ryzykiem: Opracowanie kompleksowych strategii zarządzania ryzykiem w celu złagodzenia potencjalnych zagrożeń dla bezpieczeństwa.
Zalety posiadania partnera regulacyjnego
| Zalety | Opis | |
| 1. | Ekspertyza w zakresie wymogów regulacyjnych | Dogłębne zrozumienie globalnych krajobrazów regulacyjnych i wymagań. |
| 2. | Usprawniona dokumentacja | Zapewnia dokładne i zgodne z przepisami przygotowanie dokumentacji. |
| 3. | Wydajny proces składania wniosków | Redukuje czas i koszty dzięki wydajnemu zarządzaniu zgłoszeniami. |
| 4. | Zwiększona zgodność | Minimalizuje ryzyko opóźnień i odrzuceń dzięki dokładnej zgodności. |
| 5. | Skuteczne zarządzanie ryzykiem | Proaktywna identyfikacja i ograniczanie potencjalnych zagrożeń. |
Podsumowanie
Osiągnięcie wymienności z produktem referencyjnym jest wymagającym, ale niezbędnym procesem dla pomyślnego zatwierdzenia leków biopodobnych. Wymaga kompleksowego zrozumienia wymogów regulacyjnych, skrupulatnego planowania i solidnych danych klinicznych. Współpraca z doświadczonym dostawcą usług regulacyjnych może znacznie zwiększyć szanse na sukces, zapewniając, że lek biopodobny spełnia rygorystyczne kryteria określone przez organy regulacyjne. Wykorzystując wskazówki ekspertów, dokładną dokumentację i strategiczne zarządzanie ryzykiem, sponsorzy mogą skuteczniej poruszać się po złożonej ścieżce do wymienności.









