
Zarządzanie zmianami po zatwierdzeniu jest istotnym, ale często pomijanym aspektem zarządzania cyklem życia produktu farmaceutycznego. Po zatwierdzeniu produktu leczniczego musi on nadal spełniać normy regulacyjne, aby zapewnić jego bezpieczeństwo, skuteczność i jakość. Wiąże się to z wprowadzaniem niezbędnych zmian w produkcie, jego procesie produkcyjnym lub opakowaniu.
Zmiany te często obejmują poprawę wydajności produkcji, rozwiązywanie kwestii bezpieczeństwa lub zgodność z najnowszymi i/lub nowymi wymogami regulacyjnymi. Zarządzanie tymi zmianami wiąże się jednak z kilkoma ukrytymi wyzwaniami, które mogą mieć wpływ na cykl życia produktu i jego obecność na rynku. W takim przedsięwzięciu niezbędna jest obecność partnera ds. regulacji, który zajmie się zarządzaniem procesem zmian i sprawnie poprowadzi działania regulacyjne.
Przeszkody dla firmy farmaceutycznej
Poruszanie się po zmianach po zatwierdzeniu wiąże się ze złożonością, która jest znacząca w różnych regionach, tworząc przeszkody w zakresie zgodności. Dodatkowo, zapewnienie integralności danych, koordynacja wielu interesariuszyi zarządzanie obszerną dokumentacją może być zniechęcające. Brak skutecznego zarządzania tymi aspektami może skutkować brakiem zgodności z przepisami, wycofywaniem produktów oraz poważnymi szkodami dla reputacji i działalności operacyjnej.
Kilka wyzwań związanych z zarządzaniem zmianami po zatwierdzeniu
- Złożoność przepisów
- Różne organy ds. zdrowia na całym świecie mają unikalne wymagania dotyczące zmian po zatwierdzeniu, które wymagają dogłębnego zrozumienia specyficznych wytycznych i harmonogramów każdego regionu. Zrozumienie tych różnic ma kluczowe znaczenie dla terminowego i skutecznego składania wniosków.
- Opóźnienia w zrozumieniu tych przepisów mogą prowadzić do znacznych komplikacji w cyklu życia produktu.
- Integralność danych
- Zapewnienie dokładności i integralności danych przekazywanych w celu wprowadzenia zmian po zatwierdzeniu ma kluczowe znaczenie. Niedokładne lub niekompletne dane mogą prowadzić do odrzucenia przez organy regulacyjne i znacznych opóźnień.
- Utrzymanie wysokich standardów jakości danych wymaga rygorystycznych procesów walidacji i częstych audytów w celu zapobiegania rozbieżnościom.
- Koordynacja interesariuszy
- Skuteczne zarządzanie zmianami po zatwierdzeniu obejmuje koordynację między zespołami wewnętrznymi (takimi jak badania i rozwój, produkcja i zapewnienie jakości) oraz partnerami zewnętrznymi (takimi jak organizacje produkujące na zlecenie).
- Korzystanie z narzędzi do zarządzania projektami i regularne spotkania międzyfunkcyjne mogą usprawnić współpracę i zapewnić, że wszystkie strony są zgodne.
- Dokumentacja
- Szczegółowa i precyzyjna dokumentacja ma kluczowe znaczenie dla wykazania zgodności i ułatwienia sprawnego procesu przeglądu.
- Wręcz przeciwnie, złe praktyki w zakresie dokumentacji mogą prowadzić do zapytań ze strony organów regulacyjnych, dodatkowych wniosków o dane i opóźnień w składaniu wniosków.
- Zarządzanie ryzykiem
- Proaktywne zarządzanie ryzykiem pomaga w przewidywaniu wyzwań i wdrażaniu rozwiązań w celu utrzymania procesu składania wniosków na właściwym torze.
- Skuteczny plan zarządzania ryzykiem minimalizuje prawdopodobieństwo niepowodzeń regulacyjnych i zapewnia ciągłą zgodność.
Rola eksperta ds. regulacji
Eksperci ds. regulacji odgrywają znaczącą rolę w pokonywaniu tych wyzwań, zapewniając specjalistyczną wiedzę i wsparcie:
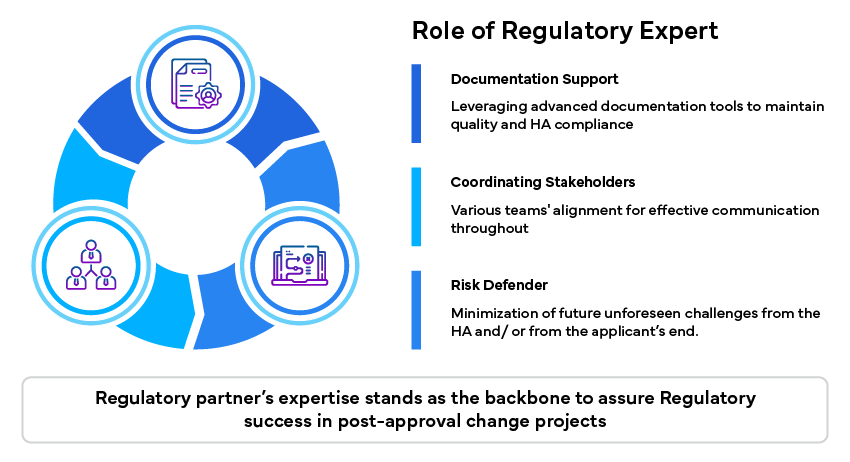
Podsumowanie
Skuteczne zarządzanie zmianami po zatwierdzeniu ma zasadnicze znaczenie dla utrzymania jakości, bezpieczeństwa i skuteczności produktów farmaceutycznych. Poruszanie się w zawiłościach regulacyjnych jest niezbędne do uzyskania zgody HA na zarządzanie zmianami. Eksperci ds. regulacji prawnych zapewniają nieocenione wsparcie w pokonywaniu tych wyzwań, oferując swoją wiedzę specjalistyczną, ułatwiając koordynację i ograniczając ryzyko. Wykorzystując ich możliwości, wnioskodawcy mogą zapewnić skuteczne zarządzanie zmianami po zatwierdzeniu i utrzymać obecność swoich produktów na rynku.









