
Un régimen de terapia farmacológica es diverso para los fármacos que pueden ser aprobados para ser utilizados en combinación con un fármaco previamente aprobado o simultáneamente desarrollado dos nuevos fármacos, que mejoran sinérgicamente la eficacia. Las terapias oncológicas con un único fármaco han puesto de manifiesto que la farmacorresistencia es una de las principales amenazas para los pacientes sometidos a tratamientos con medicamentos contra el cáncer. Teniendo en cuenta la diversidad de terapias combinadas adoptadas para el tratamiento del cáncer, los regímenes de dos fármacos están sustituyendo gradualmente a la monoterapia como norma de tratamiento en los pacientes. A lo largo de la década, la terapia combinada ha proporcionado un mejor alcance del tratamiento.
Si usted pertenece a una organización que es consciente del cambio de paradigma en el desarrollo de medicamentos contra el cáncer, que ha pasado del desarrollo de un solo fármaco a combinaciones novedosas, sabrá que este avance ha dado lugar a un aumento de las solicitudes de etiquetado cruzado por parte de los solicitantes. Al reconocer las conversaciones, las últimas tendencias del sector y su comprensión actual de los requisitos de los patrocinadores, la Administración US y Medicamentos US (USFDA) ha concedido un conjunto de directrices para proporcionar apoyo con los cambios de etiquetado para los regímenes farmacológicos con productos farmacéuticos previamente aprobados.
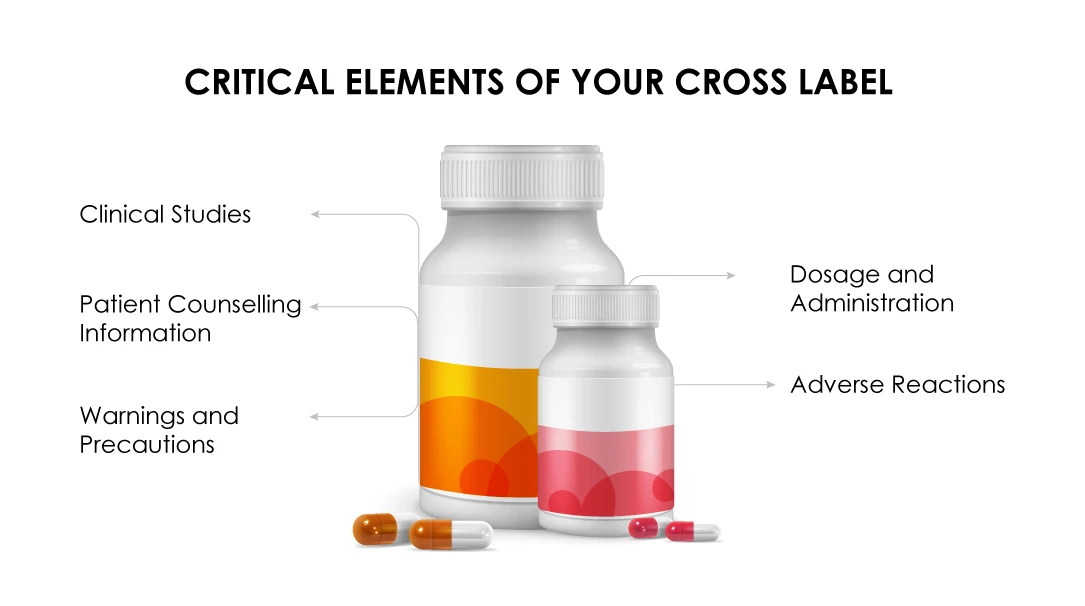
Enhorabuena. Su solicitud de orientación sobre etiquetado cruzado ha sido aceptada, si:
(a) La indicación para el régimen de combinación solicitado está aprobada bajo una indicación de Medicamento similar .
(b) La sección de Dosis y Administración debe resaltar la dosis recomendada para el medicamento del patrocinador en un régimen de combinación.
(c) Los datos del estudio clínico deben justificar los beneficios de la combinación para todos los medicamentos del régimen.
(d) La sección Advertenciasy Precauciones debe indicar la singularidad del régimen de combinación basado en datos clínicamente significativos.
(e) Deben destacarse las reacciones adversas observadas en los ensayos clínicos.
(f) Elprospecto debe limitarse a las toxicidades exclusivas de la formulación.
La información relacionada únicamente con el medicamento del promotor debe ocupar las secciones restantes de la etiqueta, a menos que sea necesario mencionar algunos factores farmacocinéticos únicos.
Las directrices aprobadas para el etiquetado cruzado se dirigen específicamente a los productos de terapia contra el cáncer para establecer los fundamentos del etiquetado cruzado. Para ayudar a los patrocinadores con los obstáculos operativos y reglamentarios relativos al cambio de etiquetado, la guía establece:
- Cronología
Se espera que los solicitantes propongan el contenido preliminar para el etiquetado cruzado con una justificación basada en pruebas del papel de cada producto mencionado en el régimen, en su propuesta para el etiquetado cruzado de un nuevo fármaco contra el cáncer en una BLA NDA BLA .
Se espera que el etiquetado cruzado se identifique para cada medicamento del régimen al mismo tiempo. Sin embargo, la aprobación puede concederse una tras otra, en una secuencia, debido a la diferencia en los plazos de los medicamentos.
- Presentación reglamentaria
Cada solicitante que desee obtener una etiqueta cruzada debe solicitarla mediante una solicitud original o un suplemento de eficacia.
Un solicitante puede optar por hacer referencia a los datos de otras solicitudes para justificar los beneficios sinérgicos del régimen combinado.
Al hacer referencia a los datos, El solicitante:
- debe asegurarse de que los datos a los que se hace referencia ya hayan sido archivados por la FDA.
- debe anotar cada sección de los datos del solicitante que sea objeto de referencias cruzadas.
- debe incluir (sección inferior) sólo la información relevante para la droga del solicitante:
- ADVERTENCIA EN CAJA (Si procede)
- FORMAS FARMACÉUTICAS Y DOSIS
- CONTRAINDICACIONES
- INTERACCIONES FARMACOLÓGICAS
- USO EN POBLACIONES ESPECÍFICAS
- SOBREDOSAGE
- DESCRIPCIÓN
- FARMACOLOGÍA CLÍNICA
- TOXICOLOGÍA NO CLÍNICA
- REFERENCIAS
- MODO DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
El etiquetado cruzado de los medicamentos contra el cáncer puede ayudar a informar a los pacientes sobre la dosis, la eficacia y las ventajas de los resultados del tratamiento. Con el aumento exponencial de la terapia combinada como método estándar, el etiquetado cruzado puede resultar beneficioso para mejorar o introducir los métodos terapéuticos actuales. Los expertos de Freyr muy familiarizados con los retos que plantea el etiquetado dinámico y pueden ofrecer soluciones a sus consultas sobre etiquetado. Disfrute del mejor servicio de asistencia profesional en materia de etiquetado. Póngase en contacto con Freyr.









