
La comunicación eficaz siempre ha garantizado la seguridad y la calidad de la atención a los pacientes. A lo largo de los años, sigue sin satisfacerse la necesidad de proporcionar traducciones de las etiquetas a las personas que no dominan el inglés. La demanda de etiquetas de productos en múltiples idiomas regionales ha crecido exponencialmente, ya que los fabricantes farmacéuticos pretenden impulsar el cambio hacia la localización y una mejor comunicación.
Cumplir estas exigencias mejorará la seguridad del paciente, al tiempo que permitirá cumplir los requisitos normativos específicos de cada país. La ausencia de información médica importante en los guiones regionales supone una carga adicional para los farmacéuticos y los profesionales sanitarios a la hora de abordar la barrera lingüística.
La Autoridad Reguladora de Productos Sanitarios (HPRA) vela por el cumplimiento de la normativa en Irlanda. La HPRA facilita y trabaja conjuntamente con las partes interesadas adhiriéndose a la guía de mejores prácticas sobre etiquetado multilingüe publicada por el Grupo de Coordinación para el Reconocimiento Mutuo y los Procedimientos Descentralizados - Humanos (CMDh). Además, la HPRA también flexibilizó ciertas condiciones de etiquetado, entre las que se incluyen:
- Uso de mL Irlanda (IE) frente a ml otros estados de la UE.
- Uso de decimales en el volumen o la concentración del producto y de un punto en IE frente a una coma en la UE. Los fabricantes de medicamentos pueden superar esta discrepancia agrupando el nombre inventado, la concentración y la forma farmacéutica como una unidad en cada idioma.
- Uso del separador en la concentración o el volumen del producto - Un punto en la UE frente a una coma en IE. Se permite el uso de comas como separador en el envase exterior inmediato para evitar cualquier riesgo de confusión en la población de pacientes irlandeses.
- Las pequeñas unidades de envasado inmediato, es decir, los envases con un tamaño inferior o igual a 50 ml, tienen una limitación de espacio y pueden alojar en ellos la información mínima requerida, siempre que esté justificado, para más de dos (02) idiomas.
- Información de terceros países: siempre que las condiciones de la información sobre el producto sean similares en el Reino Unido e Irlanda, se aceptan los envases de varios países. Los requisitos adicionales específicos de cada país se colocan en un "recuadro azul".
- Coordinación de la evaluación con los demás Member States las evaluaciones simuladas realizadas por los Member States el cumplimiento de los requisitos de etiquetado. Los solicitantes pueden coordinarse con los Member States obtener claridad sobre los cambios necesarios antes de presentar las solicitudes a la HPRA.
- Nombres conjuntos: Member States informar a la HPRA sobre el resaltado del nombre inventado que se propone a los Member States .
La HPRA formula las siguientes sugerencias adicionales para el etiquetado multilingüe:
- La información mencionada en inglés debe agruparse en un bloque.
- Mencione los requisitos de la "caja azul" para todos los países en el mismo panel cuando varios países compartan un mismo paquete.
- La información dirigida a los pacientes irlandeses debe estar claramente indicada en un código ovalado.
- Los solicitantes pueden incluir una sección perforada en el envase, siempre que los datos extraíbles no estén en inglés. Esto debe mencionarse en la presentación.
- Al final del proceso, los solicitantes deberán presentar a la HPRA un PDF del prospecto para su actualización en el sitio web.
Criterios para un paquete multilingüe:
- El nombre del producto y su potencia deben ser los mismos en todas las lenguas.
- La información que figura en la etiqueta y en el prospecto debe ser conforme con los resúmenes de las características del producto (SmPC).
- La información impresa en el etiquetado y el prospecto debe ser precisa y legible.
- El estatus legal de la droga debe ser similar en ambos países.
Un ejemplo de envase multilingüe sería:
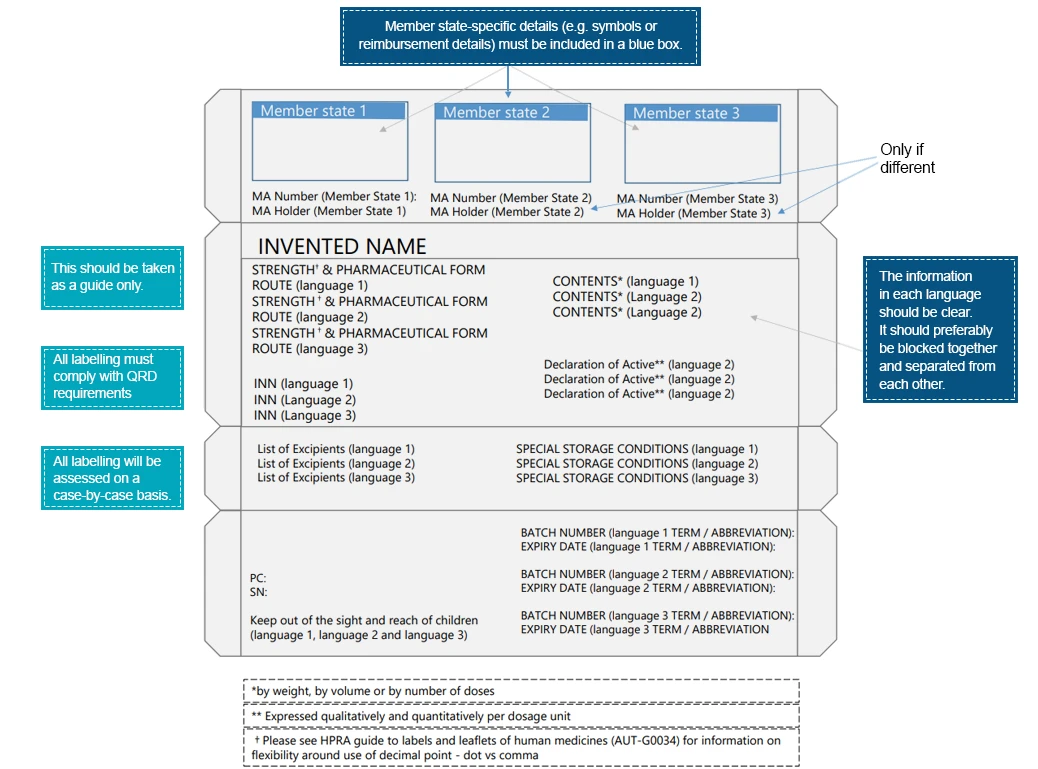
Los pacientes interactúan con las etiquetas de los medicamentos mucho antes de interactuar con el producto farmacéutico. Estas interacciones resaltan aún más la importancia de transmitir la información esencial a través de los distintos elementos de la etiqueta del medicamento. Para garantizar una mejor legibilidad y la improvisación de los elementos de la etiqueta, las empresas farmacéuticas deben tomar las medidas necesarias. Los idiomas regionales proporcionan un medio para transmitir las instrucciones médicas relevantes para el medicamento, lo que garantiza un uso seguro y eficaz del producto recetado. Los expertos en normativa específicos de cada país pueden ayudar a traducir la información de las etiquetas de conformidad con la normativa local o regional.Los expertos Freyr están perfectamente preparados para ayudar a salvar las diferencias entre la información médica y el idioma. Reach con us una ruta de etiquetado que cumpla con la normativa.









