
El desarrollo y la aprobación de medicamentos para niños es un aspecto fundamental de la atención médica pediátrica. Sin embargo, debido a consideraciones éticas y prácticas, los ensayos clínicos con niños suelen ser limitados. Como resultado, el etiquetado de los medicamentos pediátricos desempeña un papel crucial para garantizar el uso seguro y adecuado de los medicamentos en esta población vulnerable. En este blog, compararemos los requisitos de etiquetado de los medicamentos pediátricos en la Unión Europea (UE) y los Estados Unidos (US) para comprender mejor las similitudes y diferencias entre estos dos (02) marcos normativos.
Requisitos de etiquetado pediátrico de la UE
La UE tiene requisitos específicos para el etiquetado pediátrico de los medicamentos. Estos requisitos garantizan que los medicamentos destinados a los niños se sometan a las pruebas adecuadas, se autoricen y se etiqueten de forma adecuada para ofrecer opciones de tratamiento seguras y eficaces a los pacientes pediátricos.
Usizar la seguridad de los medicamentos pediátricos. Contáctenos.
Garantizar ya la seguridad de los medicamentos pediátricos
He aquí algunos aspectos de los requisitos de etiquetado pediátrico de la UE:
- Planes de investigación pediátrica (PIP): antes de que un medicamento pueda ser aprobado para su uso en niños, debe presentarse un PIP a la Agencia Europea de Medicamentos (EMA). En él se describen los estudios y los datos necesarios para evaluar la seguridad, la eficacia y la dosificación del medicamento en la población pediátrica.
- Autorización de comercialización para uso pediátrico (PUMA): Si un medicamento se ha estudiado en niños y cumple los requisitos, puede recibir una PUMA. Esta autorización permite comercializar el medicamento para uso pediátrico.
- Formulaciones adecuadas a la edad: Los medicamentos de uso pediátrico deben estar disponibles en formulaciones adecuadas para los distintos grupos de edad, como líquidos, comprimidos masticables o dispositivos dosificadores apropiados para cada edad.
- Resumen de las características del producto específico para pediatría (SmPC): El SmPC un documento que proporciona información detallada sobre un medicamento. En el caso de los productos pediátricos, debe incluir detalles específicos sobre la dosificación, la administración y las consideraciones de seguridad para los diferentes grupos de edad.
- Advertencias y precauciones pediátricas: El etiquetado debe incluir cualquier advertencia o precaución específica relacionada con el uso del medicamento en niños, como posibles efectos secundarios o interacciones con otros medicamentos de uso común en pacientes pediátricos.
- Supervisión y actualizaciones continuas: Una vez aprobado el uso pediátrico de un medicamento, pueden ser necesarios estudios posteriores a la autorización para recopilar datos adicionales sobre su seguridad y eficacia. Estos estudios pueden dar lugar a actualizaciones del etiquetado, según sea necesario.
Requisitos de etiquetado US
En US, la Administración de Alimentos y Medicamentos (FDA) ha implementado la Ley de Equidad en la Investigación Pediátrica (PREA) y la Ley de Mejores Medicamentos para Niños (BPCA) con el fin de promover la investigación y el etiquetado de medicamentos pediátricos. La PREA exige a las empresas farmacéuticas que realicen estudios pediátricos para determinados medicamentos que puedan utilizarse en niños. La BPCA concede seis (06) meses adicionales de exclusividad comercial a las empresas que realicen estos estudios.
La FDA otras directrices para garantizar la seguridad, la eficacia y la dosificación adecuada de los medicamentos pediátricos, como se indica a continuación:
- Planes de estudios pediátricos (PSP): Los fabricantes deben presentar planes de estudios pediátricos para evaluar la seguridad y eficacia de los medicamentos.
- Información específica para cada edad: Las etiquetas deben incluir dosis, indicaciones y consideraciones de seguridad específicas para cada edad.
- Dosificación en función del peso: Las recomendaciones de dosificación en función del peso garantizan una administración precisa.
- Reacciones adversas: Proporcionar reacciones adversas específicas pediátricas y datos de seguridad.
- Formulaciones específicas pediátricas: Los medicamentos pueden necesitar formas farmacéuticas específicas para pediatría (por ejemplo, líquidos y comprimidos masticables).
- Ingeniería del factor humano: Las etiquetas deben tener en cuenta la facilidad de administración para los cuidadores.
- Folletos de información al paciente: Se requieren instrucciones claras de administración, dosificación y efectos secundarios.
La siguiente tabla muestra las diferencias y similitudes entre los requisitos de etiquetado US la UE:
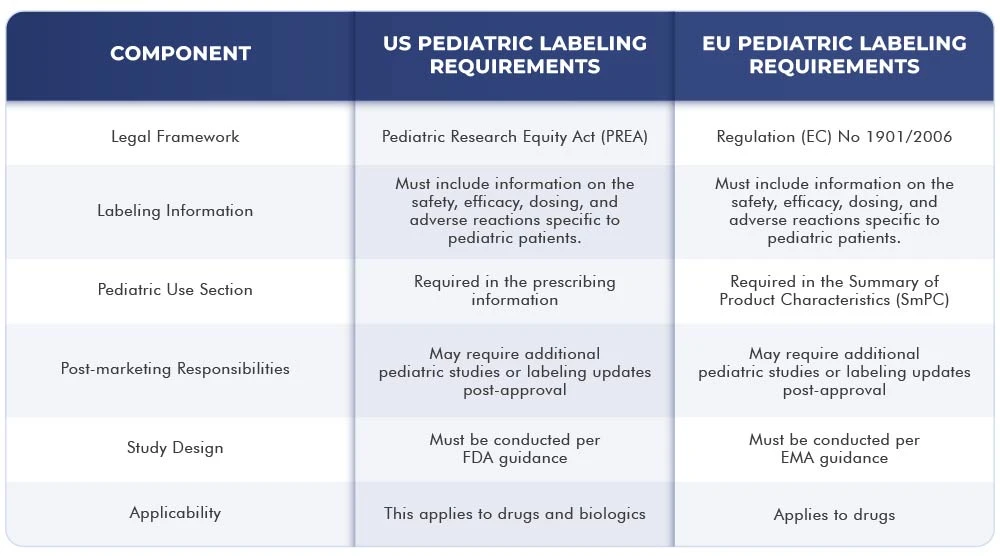
Conclusión
Los requisitos de etiquetado de medicamentos pediátricos en la UE y US garantizar el uso seguro y adecuado de los medicamentos en niños. Si bien existen similitudes entre los dos marcos normativos, como la necesidad de realizar estudios pediátricos y la inclusión de información específica sobre pediatría en el etiquetado de los medicamentos, también hay diferencias notables. Comprender estas similitudes y diferencias es fundamental para que las empresas farmacéuticas, los proveedores de atención médica y los reguladores garanticen que los niños tengan acceso a medicamentos seguros y eficaces.
Consulte a un experto en etiquetado de probada eficacia, como Freyr cumplir con los requisitos de etiquetado específicos de cada país.









