
Con la implementación por parte de la Administración US y Medicamentos US (USFDA) de la norma definitiva para las regulaciones del sistema de gestión de calidad (QMSR) en 2024, Dispositivos Médicos deben adoptar las enmiendas para comercializar y distribuir sus dispositivos en el mercado estadounidense.
Esta norma actualiza las Regulaciones del Sistema de Calidad (QSR) USFDAalineándolas con la ISO 13485:2016, que es la norma internacional para Dispositivos Médicos . Dispositivos Médicos tienen un período de transición de dos años para cumplir con la norma, lo que hace necesario que las organizaciones se adapten a los nuevos requisitos para evitar el incumplimiento en el momento de la inspección.
¿Qué es el QMSR?
FDA es un enfoque simplificado de los requisitos del QMS, que supone una actualización de la antigua estructura del QSR. Esta armonización es fundamental, ya que simplifica el cumplimiento normativo a nivel mundial para los fabricantes, especialmente para aquellos que operan a escala global. Esta armonización permitirá a las empresas cumplir los requisitos normativos tanto en US en otros mercados de una manera mucho más unificada.
El QMSR exige mejoras en la gestión de riesgos, el diseño de dispositivos y la vigilancia posterior a la comercialización. Esta función puede añadir más complejidad, pero también permite a los fabricantes estandarizar sus procedimientos de calidad, lo que a su vez aumenta la seguridad de los dispositivos y mejora la documentación, lo que puede ser vital durante USFDA .
Principales cambios en el QMSR
- Armonización con ISO 13485: Este es el paso más importante, ya que permite a Dispositivos Médicos aceptar normas reconocidas internacionalmente. La USFDA que muchas empresas de dispositivos médicos ya cumplen con ISO 13485, lo que reduce la duplicación de esfuerzos.
- La gestión de riesgos hace hincapié en la gestión de riesgos a lo largo de todo el ciclo de vida de los Dispositivos Médicos. Dispositivos Médicos deben demostrar una gestión eficaz de los riesgos, su control y su gestión.
- Diseño y controles de los dispositivos: En virtud del QMSR, los controles de diseño se ampliaron para garantizar que Dispositivos Médicos tengan plenamente en cuenta las necesidades de los usuarios, la seguridad del dispositivo y los criterios de rendimiento, lo cual es un área de interés durante USFDA
- Vigilancia postmercado: Las empresas deben mejorar el sistema de vigilancia posterior a la comercialización. De este modo, los fabricantes podrán recabar información sobre la seguridad y la eficacia de los productos, lo que ayudará a detectar e identificar rápidamente los problemas.
- Documentación y mantenimiento de registros: Esta es la norma final que hace hincapié en la documentación. Un registro exhaustivo y adecuado es fundamental durante la inspección.
Pasos para prepararse para la inspección de la Administración US y Medicamentos US :
Como la inspección durará hasta 2026, las empresas disponen de dos años para sus sistemas de calidad, lo que se ajusta al QMSR. Sin embargo, esperar al último minuto puede ser arriesgado.
Pasos para USFDA en el marco del QMSR para industrias en las que el QMS actual se basa en el QSR:
- Realización de un análisis de carencias: Este es el primer paso cuando el sistema de calidad actual difiere de los nuevos requisitos del QMSR. Un análisis exhaustivo de las deficiencias ayudará a identificar las áreas que necesitan actualizaciones, como la gestión de riesgos, la vigilancia posterior a la comercialización y los controles de diseño.
- Actualice el procedimiento de gestión de riesgos: Asegúrese de que las actividades de gestión de riesgos se combinan con todo el ciclo de vida de su producto, desde el diseño hasta la vigilancia posterior a la comercialización.
- Revisar el control del diseño: Los fabricantes deben asegurarse de que el proceso de diseño es sólido y está bien documentado. Valide que el proceso de diseño sea sólido y esté bien documentado y plenamente integrado en su sistema de gestión de la calidad.
- Mejorar la vigilancia posterior a la comercialización: Implantar sistemas para supervisar el rendimiento del dispositivo después de su comercialización. Podría implicar el establecimiento de mecanismos de retroalimentación de los clientes, la recopilación de pruebas de datos clínicos y un estrecho seguimiento de los mismos.
- Formación y documentación: Formar al personal sobre los nuevos requisitos, especialmente a aquellos que participan en la gestión de la calidad y el cumplimiento normativo. Esto garantiza que todo el proceso de documentación se ajuste a las expectativas del QMSR.
- Certificación de terceros: si su empresa no cuenta ISO 13485 , tal vez sea el momento de considerarla. Obtener ISO 13485 puede darle una ventaja a la hora de cumplir los requisitos de USFDA aumentar su credibilidad en los mercados globales.
Navegar por el periodo transitorio de dos años
Para aprovechar eficazmente el período de transición y garantizar el cumplimiento de la normativa sobre sistemas de gestión de la calidad (QMSR) USFDA, los fabricantes deben adoptar un enfoque proactivo. A continuación se sugiere una hoja de ruta:
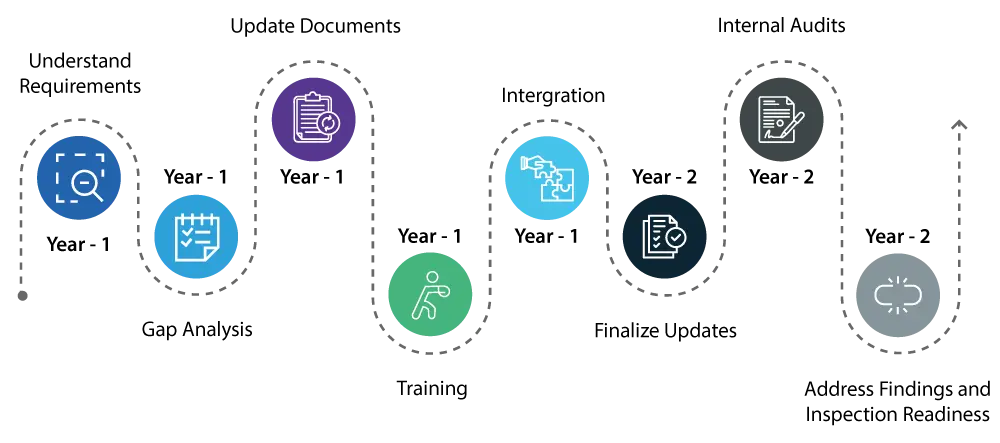
Primer año:
- Comprender los requisitos: Empiece por comprender a fondo los cambios introducidos por el QMSR. Esto implica un examen detallado de los nuevos requisitos y de sus diferencias con el Reglamento sobre sistemas de calidad (QS) vigente.
- Conozca las lagunas : Realice un análisis exhaustivo de las lagunas para identificar las áreas de su sistema de calidad actual que requieren actualizaciones para cumplir las nuevas normas QMSR.
- Actualización / corrección de documentos : Inicie las actualizaciones necesarias de su sistema de calidad, centrándose en áreas como la gestión de riesgos y los controles de diseño, que son componentes críticos del QMSR.
- Formación : Empiece a formar a su personal sobre la nueva normativa para asegurarse de que todos los implicados son conscientes de los cambios y comprenden su papel en el cumplimiento de la normativa.
- Integración : Empiece a integrar los nuevos requisitos del QMSR en sus operaciones diarias para que la transición sea más fluida.
Segundo año:
- Continúe con la aplicación de los cambios en su sistema de calidad, asegurándose de que todas las actualizaciones estén plenamente integradas y operativas.
- Lleve a cabo auditorías internas exhaustivas para verificar que las actualizaciones son efectivas y que su sistema de calidad se ajusta plenamente a los requisitos del QMSR.
- Aborde con prontitud cualquier hallazgo de las auditorías internas para garantizar que todos los aspectos de su sistema de calidad son conformes.
- Al final del segundo año, su sistema de calidad deberá cumplir plenamente con el QMSR, y usted deberá estar preparado para USFDA con la confianza de que no habrá problemas importantes.
Al seguir esta hoja de ruta, los fabricantes no solo pueden cumplir los requisitos USFDA, sino también establecer un sistema de calidad sólido que sea eficiente, estandarizado y reconocido a nivel mundial. Este enfoque proactivo ayudará a garantizar una transición fluida a las nuevas regulaciones y a mantener los más altos estándares de calidad y seguridad para los dispositivos médicos.
Conclusiones: Tomar medidas proactivas
Prepararse para USFDA en virtud de la nueva norma QMSR no solo consiste en evitar sanciones, sino también en mejorar la seguridad y la eficacia de los dispositivos. Al armonizarse con ISO 13485, la USFDA expectativas más elevadas, pero también ofrece una vía para un cumplimiento global más racionalizado. Los fabricantes que comiencen a adaptarse pronto deben centrarse en áreas clave como la gestión de riesgos y la vigilancia poscomercialización, y asegurarse de que sus sistemas de calidad estén actualizados y sean sólidos, lo que no solo satisfará las expectativas normativas, sino que también mejorará su ventaja competitiva en el mercado.
