
Le Conseil international d'harmonisation des exigences techniques pour les produits pharmaceutiques à usage humain (ICH) est une organisation internationale à but non lucratif qui s'efforce de maintenir une base de données actualisée afin de réunir les agences réglementaires et les fabricants de produits pharmaceutiques pour discuter des aspects scientifiques et techniques de l'industrie sur une plateforme unique. Le dictionnaire médical pour les activités réglementaires (MedDRA), détenu et développé par ICH, est un dictionnaire réglementaire distinct et normalisé qui facilite la communication des informations réglementaires à travers le monde, de manière transparente. De même, pionnière dans le domaine de la terminologie clinique, la Systematized Nomenclature of Medicine (SNOMED) International est une organisation à but non lucratif qui gère la base de données terminologique la plus complète au monde, la Systematized Nomenclature of Medicine -- Clinical Terms (SNOMED CT), qui comprend plus de 350 000 concepts couvrant les diagnostics, les signes et les symptômes.
Dans une étude publiée en 2009, la faisabilité d'utiliser SNOMED CT comme point d'entrée pour coder les effets indésirables des médicaments et les mapper automatiquement vers MedDRA à des fins de reporting et d'interopérabilité avec les référentiels existants a été analysée. Conscients de la portée d'une telle collaboration, ICH SNOMED ont annoncé conjointement la publication de nouvelles cartes importantes dans les domaines réglementaire et clinique. Les efforts de collaboration dans le cadre du projet WEB-RADR 2 ont abouti à la publication de deux (02) feuilles de route importantes (MedDRA vers SNOMED CT et SNOMED CT vers MedDRA) qui ont été structurées autour de la répétabilité de l'utilisation des termes et des termes MedDRA supplémentaires clés en matière de pharmacovigilance identifiés par l'Agence européenne des médicaments (EMA). Afin de promouvoir la sécurité des médicaments, l'interopérabilité entre la base de données de pharmacovigilance (MedDRA) et les dossiers médicaux électroniques (SNOMED CT) peut aider à identifier les effets secondaires possibles et à activer simultanément la notification des événements indésirables. Les données collectées grâce à ces rapports peuvent être utiles pour mener des recherches épidémiologiques sur la démographie des patients. Les éléments clés associés à la notification des événements indésirables MedDRA pourraient être utilisés pour associer les événements indésirables liés aux médicaments tout en fournissant une « aide à la prise de décision clinique ».
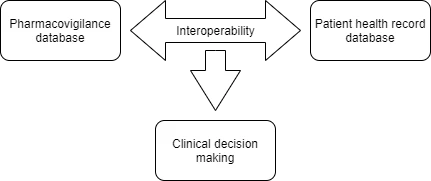
La version de production des deux cartes est mise à la disposition des utilisateurs licenciés de la SNOMED CT et de MedDRA à partir du 30 avril 2021 et sera basée sur la version de janvier 2021 de la SNOMED CT et la version de septembre 2020 de MedDRA. Il a été décidé que les cartes seraient publiées chaque année en avril.
Pour accéder aux cartes :
- Utilisateurs licenciés de MedDRA, visitez la page Téléchargements sur le site web de MedDRA.
- Les utilisateurs licenciés de la SNOMED CT visitent SNOMED International
Les récentes mises à jour concernant l'interopérabilité établie entre la base de données de pharmacovigilance et les dossiers médicaux des patients peuvent sembler complexes à appréhender. Cependant, les professionnels expérimentés de Freyr en matière de réglementation peuvent servir de point de contact unique pour fournir une assistance technique sur la base de données médicales des patients et les besoins accrus en matière de prise de décision clinique. Afin d'améliorer la qualité de vos exigences en matière de pharmacovigilance, nous vous assistons dans les domaines suivants : ICSR, rapports agrégés, services de personne qualifiée responsable de la pharmacovigilance (QPPV), services US , détection et évaluation des signaux, migration de bases de données, rapprochement des événements indésirables, services d'affiliation locale et bien plus encore. Pour découvrir les capacités de Freyr end-to-end , contactez-nous dès maintenant! Restez informé. Restez conforme.









