Lorsque la pandémie de COVID-19 a été reconnue pour la première fois comme une crise sanitaire mondiale en 2020, les autorités sanitaires mondiales (ASM) ont pris des mesures innovantes pour y faire face de la meilleure manière possible. De même, les entreprises pharmaceutiques ont mis au point plusieursProduits médicaux l'intérêt du public. Cependant, l'enregistrement de ces produits s'est avéré assez difficile. Afin de simplifier l'enregistrement tout en garantissant leur sécurité, leur qualité et leur efficacité, les autorités sanitaires ont accordé des autorisations d'utilisation d'urgence (EUA) à quelques vaccins et produits connexes.
La question peut se poser de savoir comment les autorités sanitaires ont pu s'assurer que les avantages de ces produits l'emportaient sur les risques. La réponse est l'adoption des meilleures pratiques de pharmacovigilance (PV).
Qu'est-ce que la pharmacovigilance ?
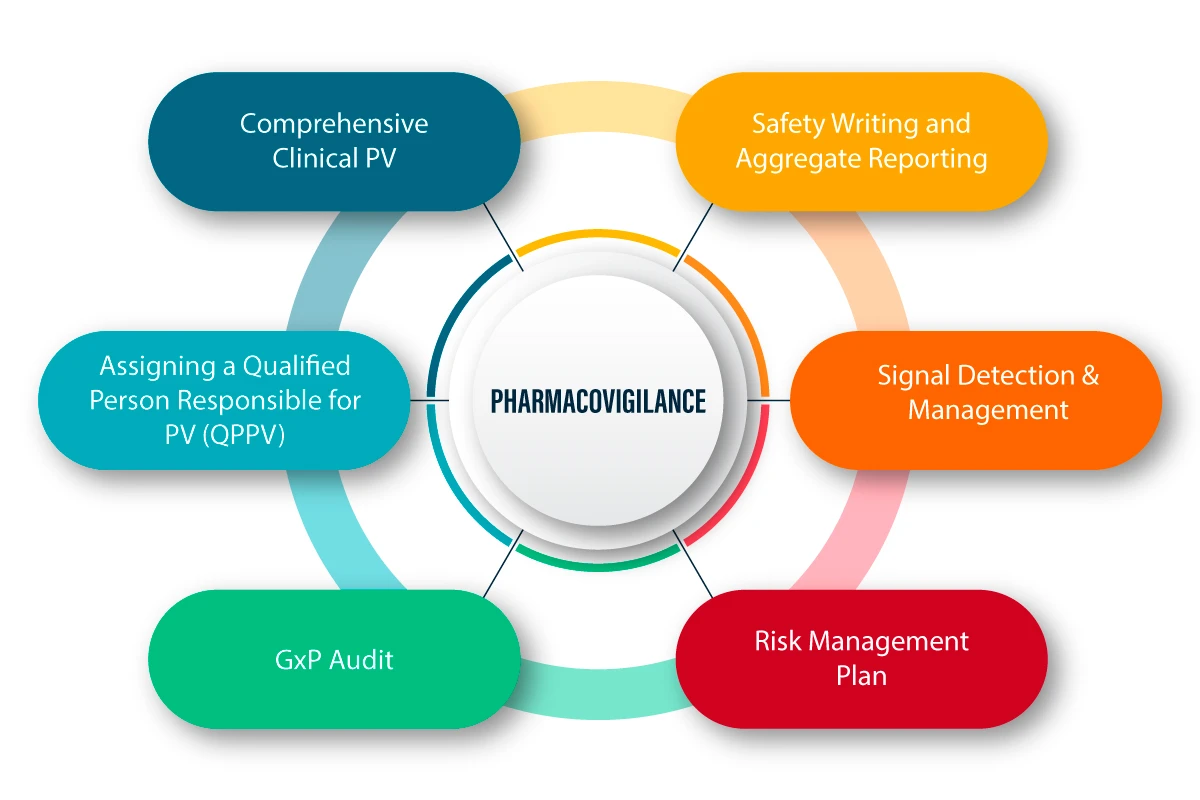
La PV est définie comme un ensemble d'activités scientifiques liées à la détection, à l'évaluation, à la compréhension et à la prévention des effets indésirables et de tout autre problème lié aux médicaments. Voici une explication figurative du fonctionnement de la PV et de son processus.
PV dans la pandémie de COVID-19
Lorsque la pandémie de COVID-19 a commencé à se propager à travers le monde, les vaccins et Produits médicaux concernés Produits médicaux dû être mis sur le marché dans un délai limité, tout en respectant les normes de qualité requises. Dans un tel contexte, le nombre de sujets disponibles pour les essais cliniques pendant la phase de développement des médicaments/vaccins était réduit, et le processus a dû être mené à bien plus rapidement que d'habitude. Cela pourrait entraîner l'apparition de certains effets indésirables après l'autorisation de mise sur le marché.
Par conséquent, l'équilibre entre les avantages et les risquesProduits médicaux considéré comme primordial. Grâce à la communication rapide des effets indésirables et des effets secondaires nocifs, l'efficacité des produits a été maintenue en temps réel.
Voici quelques-unes des principales activités de PV qui ont contribué à maintenir la sécurité, la qualité et l'efficacité de ces produits pendant la pandémie :
- Adopter un bon plan de gestion des risques
- Évaluation des risques à l'aide des rapports périodiques de sécurité (PSUR)
- Collation des données relatives à l'exposition
- Études de sécurité post-autorisation (PASS)
- Déclaration spontanée des effets indésirables suspectés
- Gestion efficace des signaux
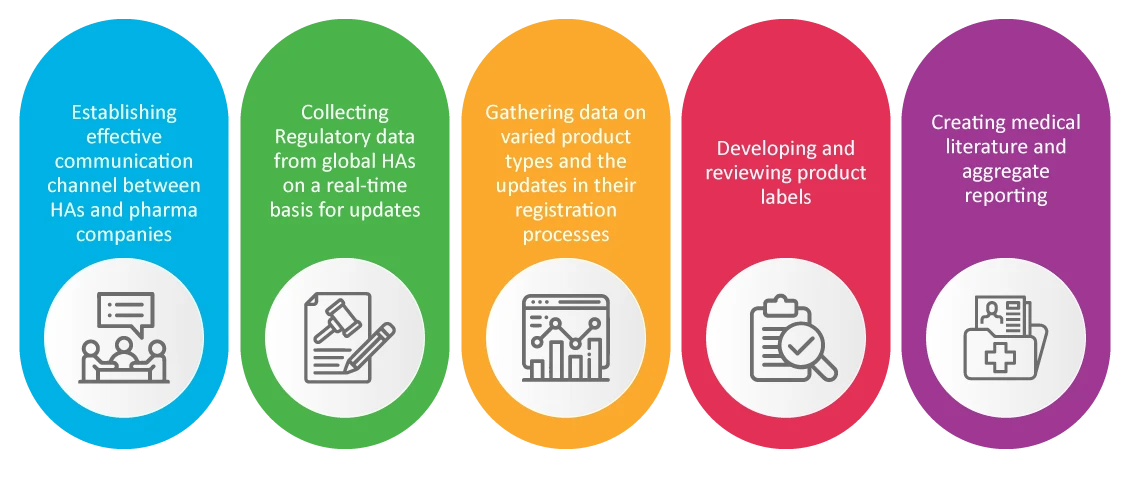
PV dans les affaires réglementaires (RA)
Il est bien connu que l'équipe chargée des affaires réglementaires d'une entreprise pharmaceutique est responsable de la sécurité et de l'autorisation des nouveaux produits. RA s'occupent des activités de pharmacovigilance qui se sont avérées cruciales pendant la pandémie, telles que :
Conclusion
En conclusion, la surveillance pharmacologique permet de contrôler et de signaler la sécurité d'un médicament. Grâce à des rapports individuels de cas (ICSR) personnalisés, il devient plus facile pour les fabricants/promoteurs de se conformer aux réglementations respectives des autorités sanitaires mondiales. Vous recherchez une assistance réglementaire pour la préparation d'ICSR ? Consultez un expert réglementaire reconnu en matière de conformité. Reach Freyr.









