Kiedy w 2020 r. pandemia COVID-19 została po raz pierwszy uznana za globalny kryzys zdrowotny, światowe organy ds. zdrowia (HA) podjęły innowacyjne działania, aby jak najlepiej sobie z nią poradzić. Podobnie firmy farmaceutyczne opracowały kilkaProdukty lecznicze korzyścią dla społeczeństwa. Jednak rejestracja tych produktów okazała się dość trudna. Aby uprościć proces rejestracji przy jednoczesnym zachowaniu bezpieczeństwa, jakości i skuteczności produktów, organy ds. zdrowia wydały zezwolenia na stosowanie w sytuacjach wyjątkowych (EUA) dla kilku szczepionek i powiązanych produktów.
Może pojawić się pytanie, w jaki sposób organy regulacyjne były w stanie zapewnić, że korzyści płynące ze stosowania wspomnianych produktów przeważają nad ryzykiem. Odpowiedź brzmi monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny przyjęcie najlepszych praktyk monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny
Czym jest monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny?
PV definiuje się jako zestaw działań naukowych związanych z wykrywaniem, oceną, zrozumieniem i zapobieganiem niepożądanym skutkom i wszelkim innym problemom związanym z lekami. Poniżej znajduje się obrazowe wyjaśnienie sposobu działania PV i związanego z nim procesu.
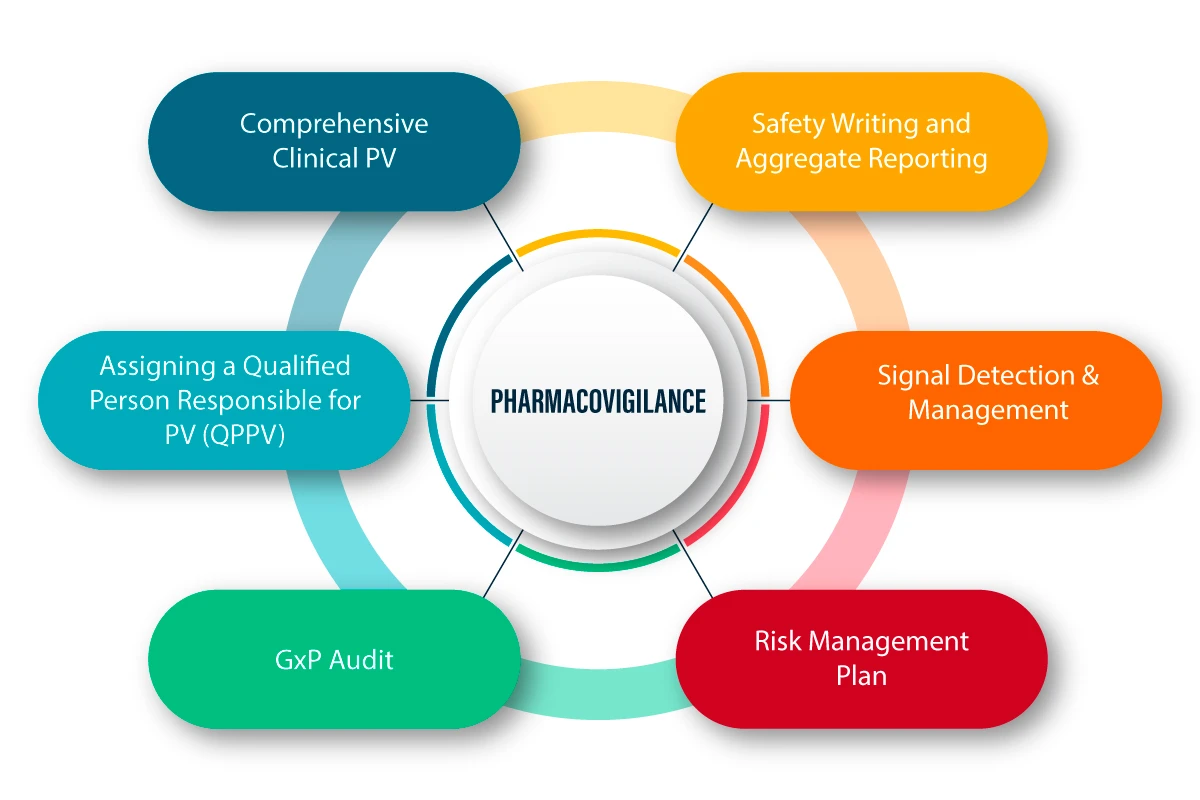
PV w czasie pandemii COVID-19
Kiedy pandemia COVID-19 zaczęła się rozprzestrzeniać na całym świecie, szczepionki i odpowiednie Produkty lecznicze zostać wprowadzone na rynek w ograniczonym czasie, przy zachowaniu wymaganych standardów jakości. W takich sytuacjach podczas fazy opracowywania leków/szczepionek dostępnych było mniej osób do badań klinicznych, a proces ten musiał zostać zakończony szybciej niż zwykle. Mogło to prowadzić do pojawienia się pewnych działań niepożądanych w fazie po zatwierdzeniu.
W związku z tym równowaga między korzyściami a ryzykiem związanym zeProdukty lecznicze uznana za sprawę najwyższej wagi. Dzięki terminowemu zgłaszaniu działań niepożądanych i szkodliwych skutków ubocznych skuteczność produktów była utrzymywana w czasie rzeczywistym.
Oto niektóre z kluczowych działań PV, które pomogły w utrzymaniu bezpieczeństwa, jakości i skuteczności wspomnianych produktów w czasie pandemii:
- Przyjęcie dobrego planu zarządzania ryzykiem
- Ocena ryzyka za pomocą okresowych raportów o bezpieczeństwie (PSUR)
- Zestawienie danych dotyczących ekspozycji
- Badania bezpieczeństwa po wydaniu zezwolenia (PASS)
- Spontaniczne zgłaszanie podejrzewanych działań niepożądanych
- Skuteczne zarządzanie sygnałami
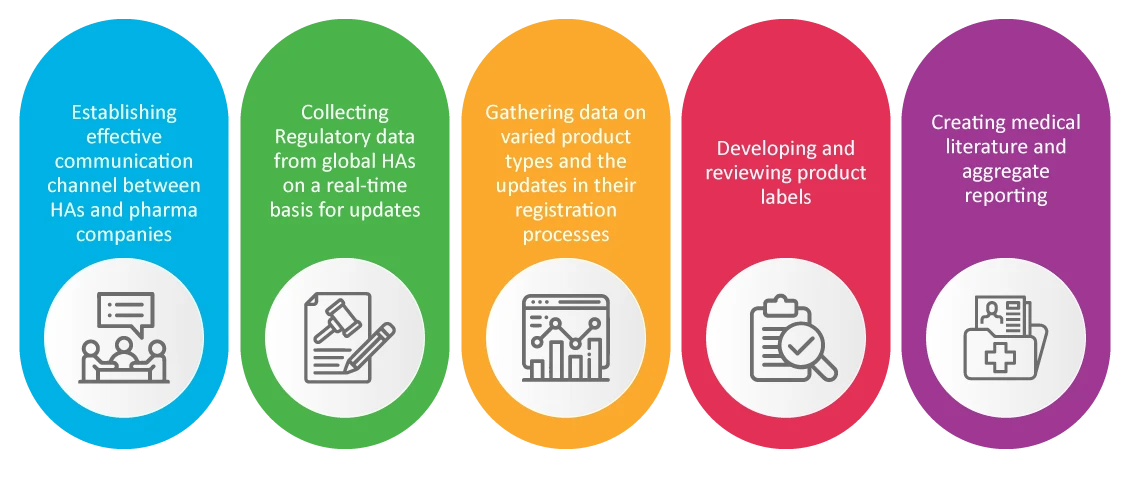
PV w Sprawy regulacyjne RA)
Powszechnie wiadomo, że Sprawy regulacyjne firmy farmaceutycznej odpowiada za bezpieczeństwo i zatwierdzanie nowych produktów. RA zajmują się monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny , co okazało się kluczowe podczas pandemii, np. monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny :
Wnioski
Podsumowując, PV pomaga monitorować i raportować bezpieczeństwo produktu leczniczego. Dzięki spersonalizowanym indywidualnym raportom z badań klinicznych (ICSR) producentom/sponsorom łatwiej jest spełniać odpowiednie przepisy globalnych organów regulacyjnych. Szukasz wsparcia regulacyjnego w zakresie przygotowywania ICSR? Skonsultuj się z doświadczonym ekspertem ds. regulacyjnych w zakresie zgodności z przepisami. Reach z Freyr.









