Cuando la pandemia de COVID-19 se reconoció por primera vez como una crisis sanitaria mundial en 2020, las autoridades sanitarias mundiales tomaron medidas innovadoras para hacerle frente de la mejor manera posible. Del mismo modo, las empresas farmacéuticas desarrollaron varias vacunas y medicamentos en beneficio de la población. Sin embargo, el registro de los productos resultó ser bastante complicado. Para simplificar el registro y mantener al mismo tiempo su seguridad, calidad y eficacia, las autoridades sanitarias concedieron autorizaciones de uso de emergencia (AUE) a algunas vacunas y productos relacionados.
Cabe preguntarse cómo han podido las autoridades sanitarias garantizar que los beneficios de dichos productos superen los riesgos. La respuesta es la adopción de las mejores prácticas de farmacovigilancia (FV).
¿Qué es la farmacovigilancia?
La FV se define como un conjunto de actividades científicas relacionadas con la detección, evaluación, comprensión y prevención de los efectos adversos y de cualquier otro problema relacionado con los medicamentos. A continuación se ofrece una explicación figurativa del funcionamiento y el proceso de la FV.
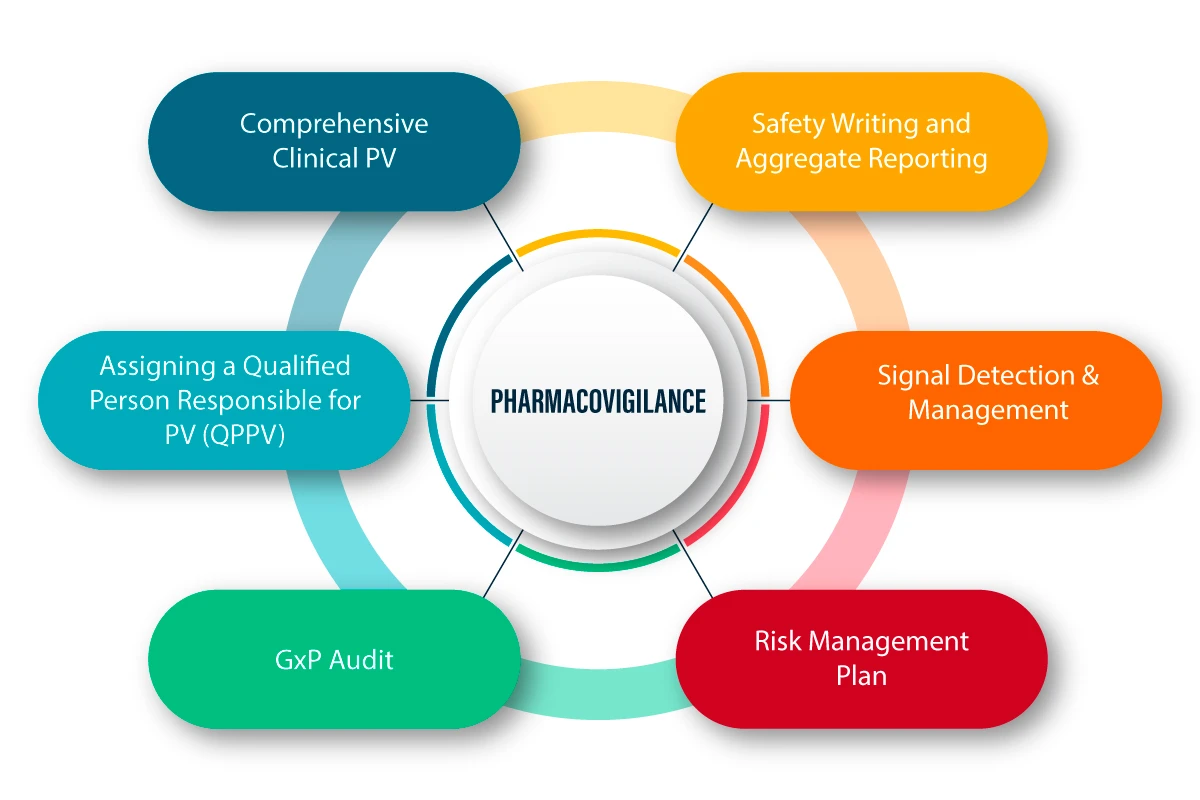
PV en la pandemia de COVID-19
Cuando la pandemia de COVID-19 comenzó a propagarse por todo el mundo, fue necesario introducir en el mercado vacunas y medicamentos relevantes en un plazo limitado, manteniendo al mismo tiempo los estándares de calidad requeridos. En tales circunstancias, había menos sujetos disponibles para los ensayos clínicos durante la fase de desarrollo de los medicamentos y vacunas, y el proceso tuvo que completarse más rápidamente de lo habitual. Esto podría dar lugar a la aparición de determinados efectos adversos en la fase posterior a la autorización.
Por lo tanto, se consideró primordial el equilibrio entre los beneficios y los riesgos de las vacunas y los medicamentos. Gracias a la comunicación oportuna de las reacciones adversas y los efectos secundarios nocivos, se mantuvo la eficacia de los productos en tiempo real.
Algunas de las actividades clave de PV que ayudaron a mantener la seguridad, calidad y eficacia de dichos productos en la pandemia son las siguientes:
- Adoptar un buen plan de gestión de riesgos
- Evaluación de riesgos con ayuda de los informes periódicos actualizados en materia de seguridad (PSUR)
- Cotejo de los datos de exposición
- Estudios de seguridad posteriores a la autorización (PASS)
- Notificación espontánea de sospechas de reacciones adversas
- Gestión eficaz de las señales
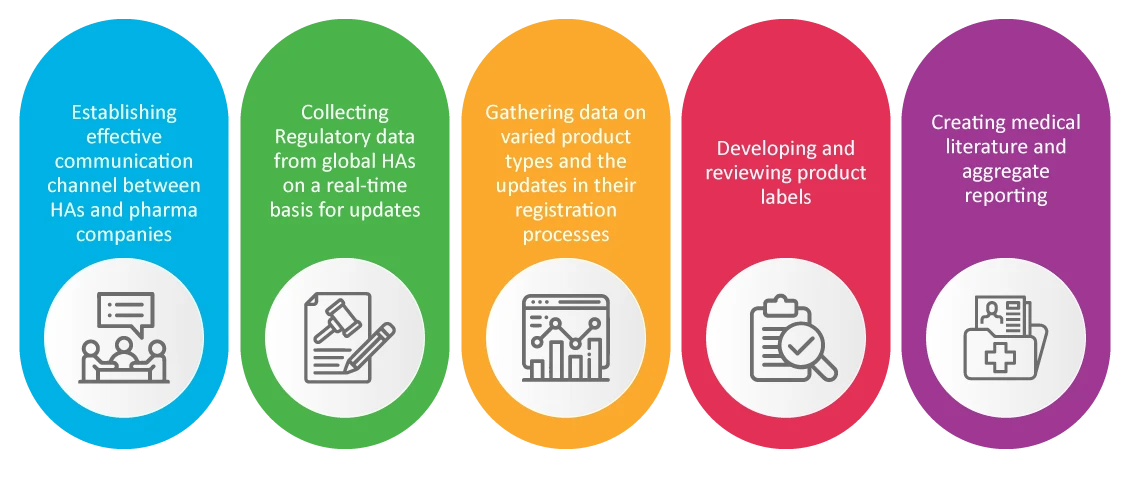
PV en Asuntos Regulatorios RA)
Es bien sabido que el Asuntos Regulatorios de una empresa farmacéutica es responsable de la seguridad y la aprobación de los nuevos productos. RA se encargan de las actividades de farmacovigilancia que resultaron cruciales durante la pandemia, tales como:
Conclusión
En conclusión, la PV ayuda a supervisar y notificar la seguridad de un medicamento. Con los informes de casos individuales (ICSR) personalizados, a los fabricantes/patrocinadores les resulta más fácil cumplir con las respectivas normativas de las autoridades sanitarias globales. ¿Busca asistencia normativa para la preparación de ICSR? Consulte a un experto en normativa con experiencia en materia de cumplimiento. Reach con Freyr.









