
La Food and Drug Administration (FDAUS a publié en décembre 2022 une mise à jour de la directive intitulée « Failure to Response to an ANDA Response Letter (CRL) Within the Regulatory Timeframe Guidance for Industry » (Directive à l'intention de l'industrie concernant l'absence de réponse à une lettre de réponse complète (CRL) à une demande abrégée de nouveau médicament ( ANDA ) dans les délais réglementaires) de juillet 2022. Ces lignes directrices sont destinées à guider les demandeurs de demandes abrégées de nouveaux médicaments (ANDA) soumises en vertu de l'article 505(j) de la loi fédérale sur les aliments, les médicaments et les cosmétiques (FD&C Act) (21 U.S.C. 355(j)). Une réponse complète et pertinente à une CRL est essentielle pour l'approbation du médicament générique. Le document d'orientation formule des recommandations concernant les répercussions de la réception d'une CRL et les mesures FDA prendre si la CRL ne reçoit pas de réponse dans le délai imparti.
La FDA s'assurer que les médicaments génériques approuvés répondent aux normes de sécurité, de qualité, d'efficacité et d'accessibilité financière. Si la demande ANDA satisfait ANDA aux exigences FDA , une lettre CRL est envoyée au demandeur, dans laquelle sont énumérées les lacunes identifiées lors de l'évaluation.
Voici une description figurative de ce qu'un demandeur peut faire dans l'année qui suit la réception de la LCR :
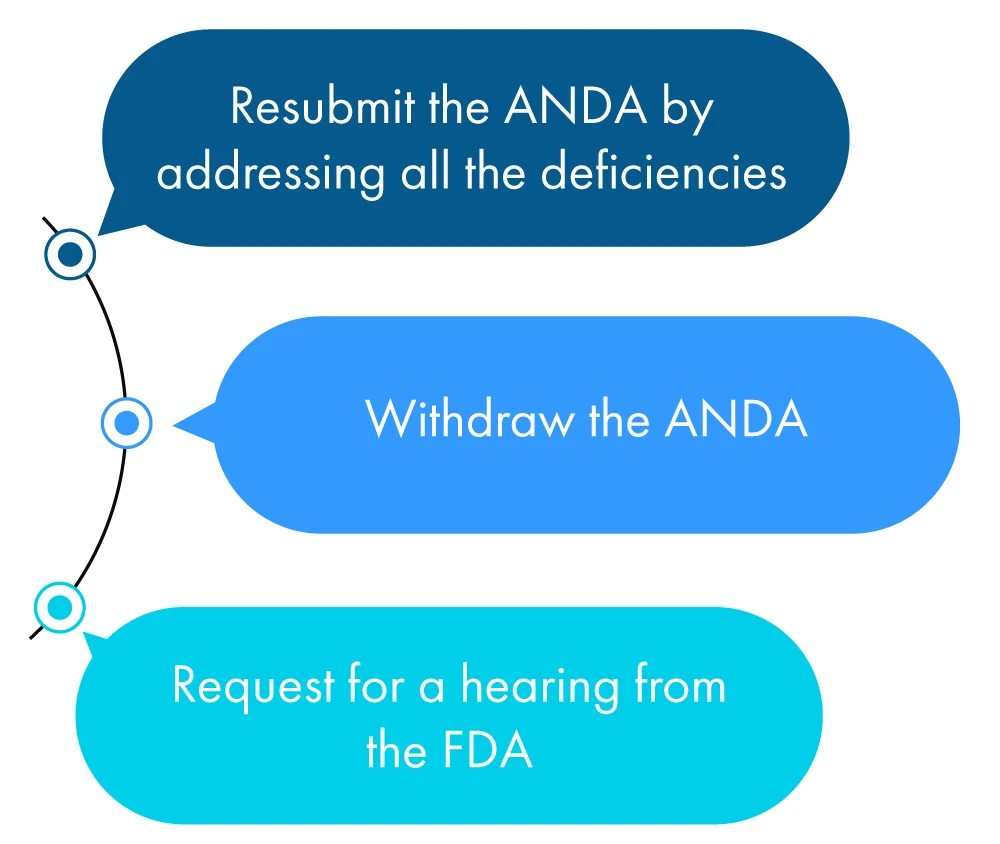
Si aucune des mesures ci-dessus n'est prise par le demandeur, la FDA cela comme une demande de retrait de ANDA le demandeur a demandé une prolongation du délai pour vérifier toutes les divergences mentionnées dans la CRL.
Que se passe-t-il après une (01) année de délivrance de la LCR ?
La FDA une notification écrite indiquant que le demandeur dispose d'un délai de trente (30) jours à compter de la notification pour :
- Donnez les raisons pour lesquelles la demande ANDA ne ANDA pas être retirée.
- Demande de prolongation du délai pour remédier à toutes les déficiences mentionnées dans la LCR
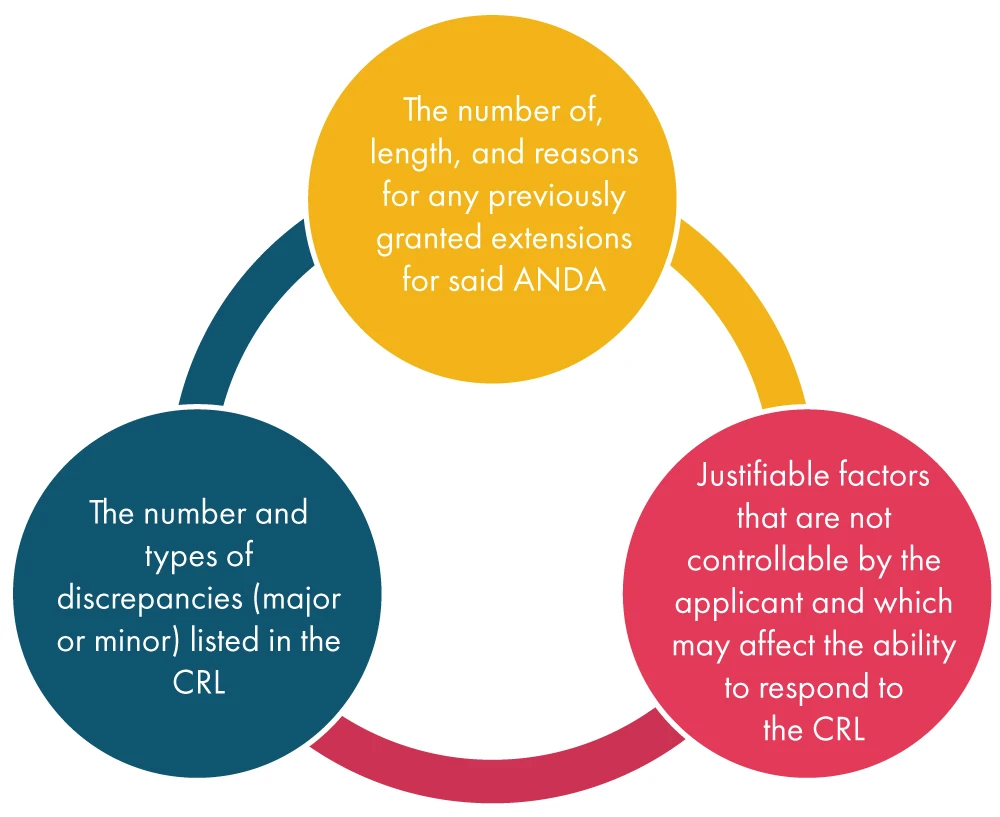
Une fois que la FDA une demande de prolongation de la part du demandeur, elle examine divers facteurs mentionnés ci-dessous, puis statue sur la demande :
Qu'est-ce qu'un amendement ?
Le demandeur doit soumettre une demande de prolongation pour répondre à une CRL par le biais d'un amendement. La FDA les amendements comme majeurs ou mineurs en fonction de leur incidence sur le processus d'approbation.
FDA essentielles FDA que les demandeurs doivent connaître :
- La FDA une modification mineure en modification majeure si celle-ci est soumise plus d'un an après la CRL, sauf si ANDA un produit figurant sur la liste des médicaments en pénurie au titre de la section 506E de la loi FD&C (21 U.S.C. 356e), ou fait l'objet d'une réponse à une urgence de santé publique déclarée par le secrétaire du US de la Santé et des Services sociaux en vertu de l'article 319 de la loi sur les services de santé publique (42 U.S.C. 247d), ou est susceptible d'être soumis aux mêmes critères que ceux qui s'appliquent à une telle déclaration, au moment de la soumission.
- Si le demandeur ne remédie pas aux divergences signalées dans la CRL dans le délai supplémentaire accordé par la FDA, cette dernière peut envisager de retirer ANDA.
- Si le demandeur a besoin d'une prolongation supérieure à trente (30) jours, il peut demander une prolongation supplémentaire. La modification doit alors inclure de nouvelles informations qui permettront à la FDA déterminer si la prolongation peut être accordée ou non.
Obtenir une CRL de la FDA être assez intimidant pour ANDA . Qu'il s'agisse de corriger les divergences ou de citer les raisons/informations correctes pour obtenir une prolongation, toutes les exigences pertinentes doivent être respectées afin de garantir une autorisation plus rapide du médicament. Freyr est un expert réglementaire reconnu qui possède une connaissance approfondie des réponses aux CRL et de la conformité aux FDA . Contactez-nous dès maintenant pour bénéficier d'un soutien end-to-end dans le cadre de ANDA .









