Les produits radiopharmaceutiques sont des médicaments pharmaceutiques contenant des radio-isotopes, utilisés comme agents diagnostiques et thérapeutiques. Ils ciblent des organes, des tissus ou des cellules spécifiques du corps humain. Ces Produits médicaux être administrés par voie orale, intraveineuse ou interstitielle, et constituent une sous-spécialité de la radiothérapie. La commercialisation des produits radiopharmaceutiques est soumise à des réglementations strictes, car ils ne peuvent être administrés que par un professionnel spécialisé en médecine nucléaire. Cependant, les opportunités sont immenses en raison de leur capacité à diagnostiquer certains problèmes médicaux ou à traiter des maladies telles que le cancer. Le marché mondial des produits radiopharmaceutiques a atteint environ US,9 milliards US en 2022, et il devrait reach 11,93 milliardsUS en 2030, avec un taux de croissance annuel composé (TCAC) de 11,76 %.
Les sociétés pharmaceutiques du monde entier tentent de s'approprier leur part du marché des produits radiopharmaceutiques, y compris celles du Canada. Health Canada SC), Health Authority (HA) canadienne Health Authority (HA) est reconnue pour ses efforts visant à offrir au public des services de santé de haute qualité. Des directives et des réglementations strictes sont en place pour garantir la sécurité des patients avant tout. Les fabricants et les promoteurs qui souhaitent pénétrer le marché canadien des produits radiopharmaceutiques doivent comprendre les réglementations mises en place par SC et concevoir en conséquence la stratégie de soumission idéale pour obtenir une autorisation de mise sur le marché plus rapide.
Feuille de route réglementaire pour les soumissions de produits radiopharmaceutiques au Canada
Tous les médicaments commercialisés au Canada doivent être conformes à la Loi sur les aliments et drogues (FDA) et au Règlement sur les aliments et drogues (RAD). Les produits radiopharmaceutiques sont énumérés à l'annexe C de la FDA. La Direction des produits biologiques et des thérapies génétiques (DPBTG) de Santé Canada réglemente l'autorisation de mise en marché de ces produits. Ils sont approuvés pour usage humain après une évaluation satisfaisante de l'innocuité, de l'efficacité et de la qualité des demandes d'homologation des produits radiopharmaceutiques.
HC est membre officiel du Conseil international d'harmonisation des exigences techniques relatives aux produits pharmaceutiques à usage humain (ICH). Il a adopté les ICH relatifs à la qualité, à la sécurité, à l'efficacité et à des sujets multidisciplinaires. La liste de ces documents est disponible sur le site Web de HC à titre de référence pour les promoteurs.
Outre les documents susmentionnés, le document intitulé Guidance for Industry: Management of Drug Submissions (document d'orientation), dont la dernière mise à jour date du 2 août 2022, us aperçu us la perspective de Santé Canada en matière d'évaluation des informations soumises par les promoteurs sur les produits radiopharmaceutiques. Le tableau ci-dessous (figure 1) donne un aperçu des sujets abordés dans le document d'orientation.
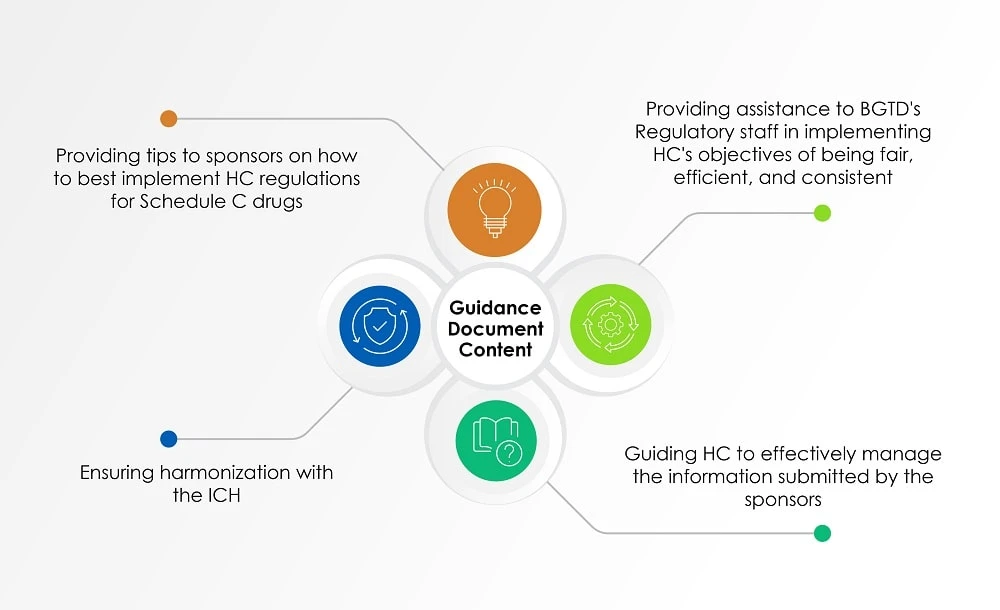
Figure 1 : Contenu d'un document d'orientation
Les exigences réglementaires pour les médicaments de l'annexe C sont les mêmes que pour les autres médicaments. Elles comprennent les demandes d'autorisation et la procédure d'obtention de l'autorisation de mise sur le marché. Cependant, les exigences en matière de données de soumission sont différentes de celles des autres médicaments en raison de leurs propriétés spécifiques.
NDS
Le fabricant/promoteur du médicament doit déposer une présentation de drogue nouvelle (PDN) auprès de la DPBTG, qui doit contenir les données suivantes :
- Informations sur la sécurité, la qualité et l'efficacité du médicament.
- Rapports/résultats des essais précliniques et cliniques.
- Informations sur la fabrication du médicament.
- Mentions d'étiquetage et d'emballage.
- Allégations thérapeutiques et effets secondaires potentiels du médicament.
Le promoteur peut faire une présentation à la DPBTG avant de soumettre la PDN. Une telle réunion préalable à la soumission est bénéfique, car le promoteur peut combler les lacunes/questions soulevées par la DPBTG et s'assurer que la soumission contient toutes les informations requises. La réunion devrait idéalement avoir lieu trois (3) mois avant la date limite de soumission.
Les promoteurs peuvent également envisager d'autres voies d'examen, telles qu'un examen prioritaire ou un avis de conformité avec conditions (AC/c). Voici un résumé de chacune de ces deux voies :
- Examen prioritaire: Cette voie s'applique à une PDN ou à un supplément à une présentation de drogue nouvelle (SPDN) pour une maladie ou un état mettant la vie en danger ou entraînant une incapacité grave, pour laquelle il existe suffisamment de preuves de l'efficacité du médicament en termes de diagnostic, de traitement ou de prévention de l'état en question. Elle est également applicable lorsqu'il y a une augmentation substantielle de l'efficacité et/ou une diminution considérable du risque pour une maladie pour laquelle il n'existe pas de médicament efficace sur le marché canadien.
- AC/c : Cette voie considère l'évaluation des risques et des bénéfices d'un médicament. L'AC-C concerne un médicament dont le profil de sécurité est acceptable pour une maladie ou un état mettant la vie en danger ou entraînant une incapacité grave. L'autorisation est accordée avec des preuves favorables pour le médicament radiopharmaceutique. Cette voie s'applique à la PDN, à la PSDN et à la présentation abrégée de drogue nouvelle (PADN).
Le format NDS
SC a adopté le format Electronic Common Technical Document (eCTD) pour les soumissions de médicaments radiopharmaceutiques. En fait, des modèles distincts de résumé des informations sur la qualité, tels que QIS-R et QIS-PER, ont été créés pour les soumissions de produits radiopharmaceutiques.
Conclusion
Alors que SC réglemente l'autorisation de mise sur le marché des produits radiopharmaceutiques sur la base d'une évaluation satisfaisante de la sécurité, de l'efficacité et de la qualité des demandes, la Commission canadienne de sûreté nucléaire (CCSN) réglemente la radioprotection des médicaments radiopharmaceutiques. La CCSN contrôle des aspects tels que la manipulation, l'emballage, l'étiquetage, le stockage, l'élimination, etc. des matières radioactives. Elle établit également des réglementations pour l'équipement utilisé dans la fabrication des médicaments radiopharmaceutiques.
La conformité aux réglementations actuelles de Santé Canada et de la CCSN est essentielle pour une évaluation satisfaisante des demandes d'autorisation de mise sur le marché de médicaments radiopharmaceutiques. Faites appel à un expert réglementaire reconnu tel que Freyr des activités de publication et de soumission sans erreur et sans heurts au Canada. Restez informé ! Restez en conformité !









