
Les études toxicologiques sont essentielles au processus d'approbation des médicaments, car elles garantissent que les nouveaux produits pharmaceutiques sont sans danger pour l'homme. Ces études évaluent les effets indésirables potentiels des nouveaux composés et déterminent des niveaux de dosage sûrs. En l'absence d'évaluations toxicologiques approfondies, les risques associés aux nouveaux produits pharmaceutiques pourraient l'emporter sur leurs avantages, entraînant de graves conséquences pour les patients et des revers pour les entreprises pharmaceutiques.
Malgré leur importance cruciale, les études toxicologiques peuvent être associées à des défis. Des évaluations toxicologiques inadéquates ou erronées peuvent entraîner des revers importants dans le développement des médicaments, notamment des retards cliniques, des exigences supplémentaires en matière de tests ou un refus pur et simple d'approbation de la part des autorités réglementaires. Ces problèmes retardent non seulement la mise à disposition de médicaments susceptibles de sauver des vies, mais augmentent également les coûts de développement et réduisent la probabilité de mise sur le marché d'un médicament.
Aspects clés des études toxicologiques
Les études toxicologiques englobent différents types d'études, chacune portant sur des problèmes de sécurité spécifiques aux produits pharmaceutiques. Nous explorons ici les principaux types d'études toxicologiques et leur rôle dans le processus d'approbation des produits pharmaceutiques.
Toxicologie préclinique
La toxicologie préclinique implique des études initiales menées in vitro et in vivo pour évaluer les niveaux de toxicité avant les essais humains/cliniques. Ces études permettent d'identifier les effets indésirables potentiels et de déterminer des plages de dosage sûres.
Études de toxicité chronique
Les études de toxicité chronique évaluent les effets d'une exposition prolongée à un médicament, ce qui est crucial pour les traitements destinés aux maladies chroniques. Ces études à long terme permettent d'identifier tout effet indésirable différé qui pourrait ne pas être apparent dans les études à court terme.
Toxicologie de la reproduction et du développement
Ces études examinent les effets potentiels d'un médicament sur la reproduction et le développement du fœtus. Elles sont essentielles pour s'assurer que les produits pharmaceutiques n'ont pas d'effets négatifs sur la fertilité ou n'entraînent pas de problèmes de développement chez la progéniture.
Tests de génotoxicité
Les tests de génotoxicité déterminent si un composé peut provoquer des mutations génétiques susceptibles d'entraîner un cancer. Ces évaluations sont essentielles pour identifier les risques cancérigènes potentiels associés aux nouveaux médicaments.
| Type d'étude toxicologique | Objectif |
|---|---|
| Toxicité aiguë | Détermine les effets immédiats d'un médicament |
| Toxicité subchronique | Évaluation des effets d'une exposition répétée sur une courte période |
| Toxicité chronique | Évaluer les effets à long terme d'une exposition prolongée |
| Toxicologie de la reproduction | Examen de l'impact des médicaments sur la fertilité et le développement du fœtus |
Le rôle des experts en réglementation
Les experts en réglementation jouent un rôle essentiel dans la réussite des études toxicologiques. Ils apportent leur expertise dans la conception et l'interprétation de ces études, en veillant au respect des normes réglementaires mondiales. Les partenaires réglementaires aident à préparer des rapports complets pour la soumission et à répondre efficacement aux questions des autorités réglementaires. Leur implication peut rationaliser le processus d'approbation et augmenter les chances de succès d'un médicament.
Avantages de la collaboration avec les partenaires réglementaires
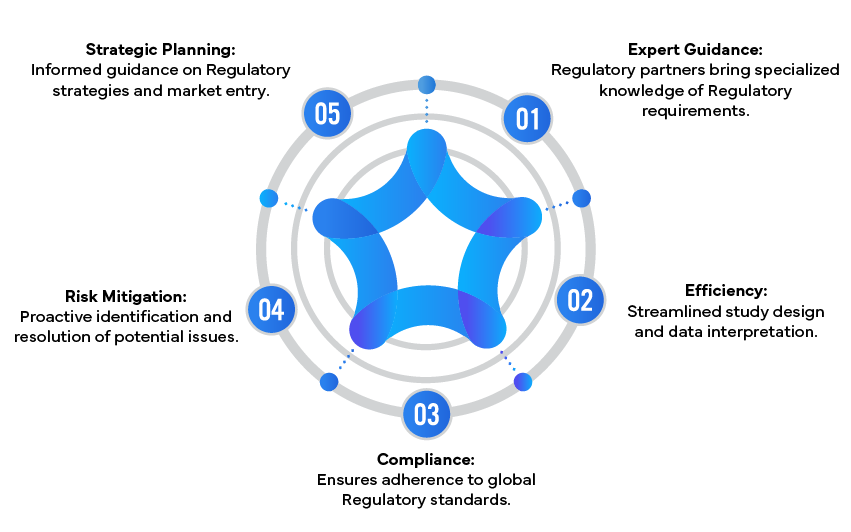
Conclusion
Les études toxicologiques sont essentielles pour établir le profil de sécurité des nouveaux produits pharmaceutiques. En abordant divers problèmes de sécurité par le biais de différents types d'évaluations toxicologiques, ces études garantissent que les nouveaux produits pharmaceutiques peuvent être utilisés sans danger par l'homme. La collaboration avec des experts expérimentés en réglementation permet de rationaliser davantage le processus d'approbation, en garantissant le respect de normes de sécurité rigoureuses et en augmentant les chances de succès d'un produit pharmaceutique sur le marché. En adoptant une approche globale et proactive de la toxicologie, les entreprises pharmaceutiques peuvent naviguer plus efficacement dans les complexités du développement de produits pharmaceutiques, pour finalement offrir aux patients des traitements plus sûrs et plus efficaces.









