
Dans l'industrie pharmaceutique, la sécurité des patients et la conformité réglementaire sont primordiales. L'évaluation et le contrôle des impuretés génotoxiques dans les médicaments constituent un aspect essentiel pour garantir ces deux éléments. La directive M7 du Conseil international d'harmonisation (ICH) fournit un cadre complet pour la gestion de ces impuretés, qui peuvent provoquer des mutations génétiques et entraîner un cancer. Même en quantités infimes, les impuretés génotoxiques présentent des risques importants pour les patients. Ces impuretés peuvent provoquer des mutations génétiques, pouvant potentiellement entraîner un cancer. Par conséquent, une identification, une évaluation des risques et un contrôle appropriés des impuretés génotoxiques sont essentiels pour atténuer ces risques et garantir la sécurité et l'efficacité des produits pharmaceutiques. Ce blog explore les aspects clés de ICH, les défis qu'elle aborde et le rôle des experts réglementaires dans la mise en conformité.
Aspects clés de ICH
La ligne directrice ICH décrit une approche structurée pour l'évaluation et le contrôle des impuretés génotoxiques. Elle comprend plusieurs éléments clés :
Évaluation des risques
L'évaluation des risques consiste à identifier les impuretés génotoxiques potentielles et à évaluer leur risque sur la base de leur structure chimique, des données relatives à des composés similaires et des données toxicologiques disponibles. Cette étape est cruciale pour déterminer quelles impuretés doivent être contrôlées et à quels niveaux.
Stratégies de contrôle
Une fois les impuretés génotoxiques potentielles identifiées, des stratégies de contrôle doivent être mises en œuvre pour limiter leur présence dans des limites acceptables. Il s'agit notamment de développer et de valider des méthodes d'analyse pour détecter les impuretés et de mettre en œuvre des contrôles de fabrication pour minimiser leur formation.
Soumission réglementaire
Une documentation complète et une justification des évaluations des risques et des stratégies de contrôle sont requises pour les soumissions réglementaires. Cela permet de s'assurer que les organismes de réglementation disposent de toutes les informations nécessaires pour évaluer la sécurité du produit pharmaceutique.
Tableau 1 : Composantes de ICH
| Composante ICH | Description |
|---|---|
| Évaluation des risques | Identifie et classe les impuretés en fonction de leur potentiel génotoxique. |
| Caractérisation des risques | Évaluer les niveaux d'exposition et les risques potentiels pour les patients |
| Mesures de contrôle | Stratégies visant à limiter ou à éliminer les impuretés au cours de la production |
(Non limité à)
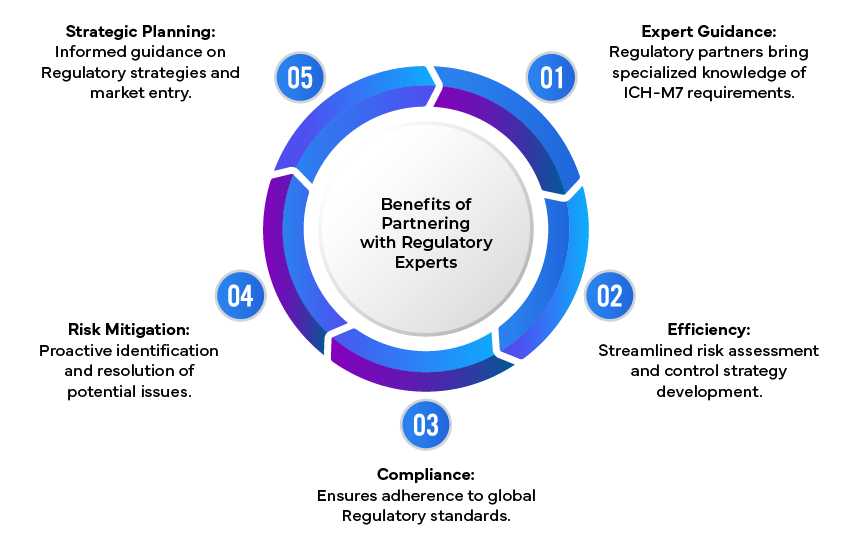
Le rôle des experts en réglementation
Il peut être difficile pour les entreprises pharmaceutiques de s'y retrouver dans les exigences complexes ICH. C'est là que les experts en réglementation jouent un rôle essentiel en fournissant des conseils spécialisés sur l'évaluation des risques, les stratégies de contrôle et la préparation de dossiers réglementaires complets. En tirant parti de leur expertise, les entreprises peuvent garantir leur conformité à ICH et atténuer les risques potentiels associés aux impuretés génotoxiques.
Résumé
La conformité à la ligne directrice ICH est essentielle pour garantir la sécurité et l'efficacité des produits pharmaceutiques. En adoptant une approche structurée pour l'évaluation et le contrôle des impuretés génotoxiques, les entreprises peuvent protéger la sécurité des patients et répondre aux exigences réglementaires. Le partenariat avec des experts en réglementation rationalise davantage ce processus, en fournissant l'expertise nécessaire pour naviguer dans des paysages réglementaires complexes et réussir les soumissions.









