
Amerykańska Agencja ds. Żywności i Leków (US FDA) opublikowała w grudniu 2022 r. wytyczne, będące aktualizacją wytycznych zatytułowanych „Brak odpowiedzi na pismo ANDA odpowiedzią (CRL) ANDA w terminie regulacyjnym – wytyczne dla branży” z lipca 2022 r. Ma on na celu udzielenie wskazówek wnioskodawcom składającym skrócone wnioski o rejestrację nowych leków (ANDA) zgodnie z sekcją 505(j) federalnej ustawy o żywności, lekach i kosmetykach (FD&C Act) (21 U.S.C. 355(j)). Kompletna i adekwatna odpowiedź na pismo CRL ma kluczowe znaczenie dla zatwierdzenia leku generycznego. Wytyczne zawierają zalecenia dotyczące konsekwencji otrzymania pisma CRL oraz działań, FDA podjąć w przypadku braku odpowiedzi na pismo CRL w określonym terminie.
FDA zapewnić, że zatwierdzone leki generyczne spełniają normy bezpieczeństwa, jakości, skuteczności i przystępności cenowej. Jeśli wniosek ANDA wymogów FDA , wnioskodawca otrzymuje pismo CRL zawierające wykaz nieprawidłowości stwierdzonych podczas oceny.
Poniżej znajduje się przykładowy opis tego, co wnioskodawca może zrobić w ciągu roku od otrzymania CRL:
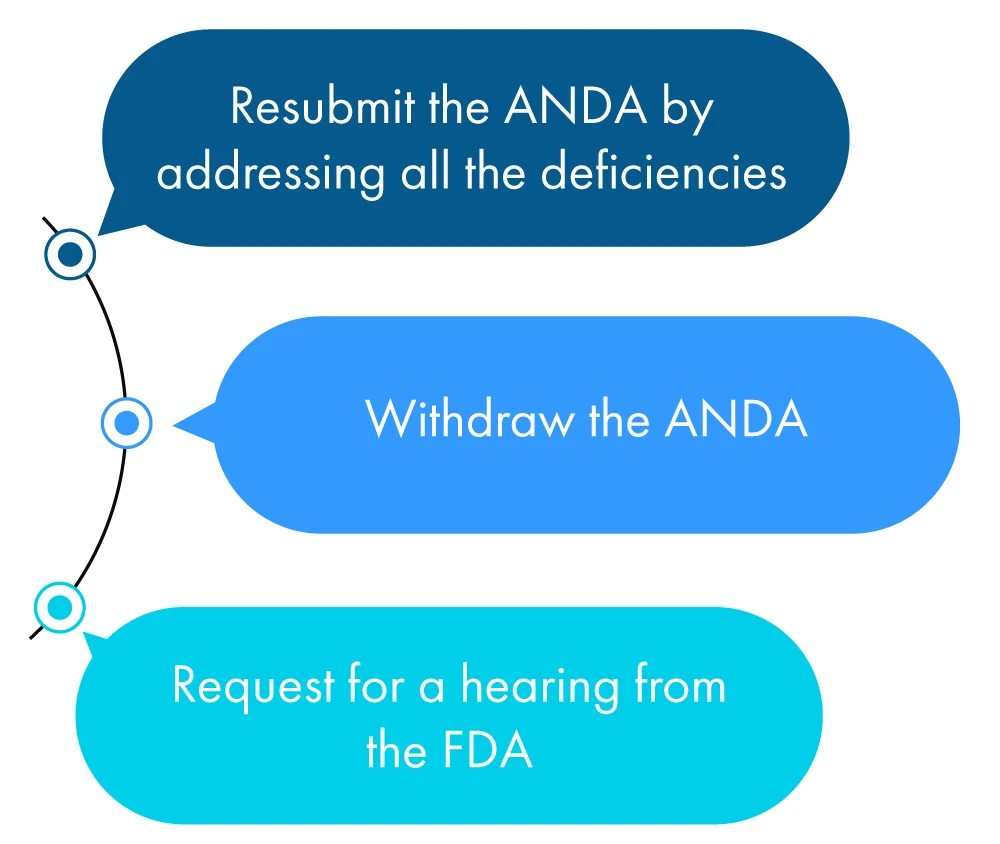
Jeśli wnioskodawca nie podejmie żadnego z powyższych działań, FDA to za wniosek o wycofanie ANDA wnioskodawca zwrócił się o przedłużenie terminu na sprawdzenie wszystkich rozbieżności wymienionych w CRL.
Co dzieje się po upływie jednego (01) roku od wydania listy CRL?
FDA pisemne zawiadomienie, że wnioskodawca ma trzydzieści (30) dni od daty zawiadomienia na wykonanie następujących czynności:
- Podaj powody, dla których wniosek ANDA nie ANDA zostać wycofany.
- Wniosek o przedłużenie terminu na usunięcie wszystkich uchybień wymienionych w CRL
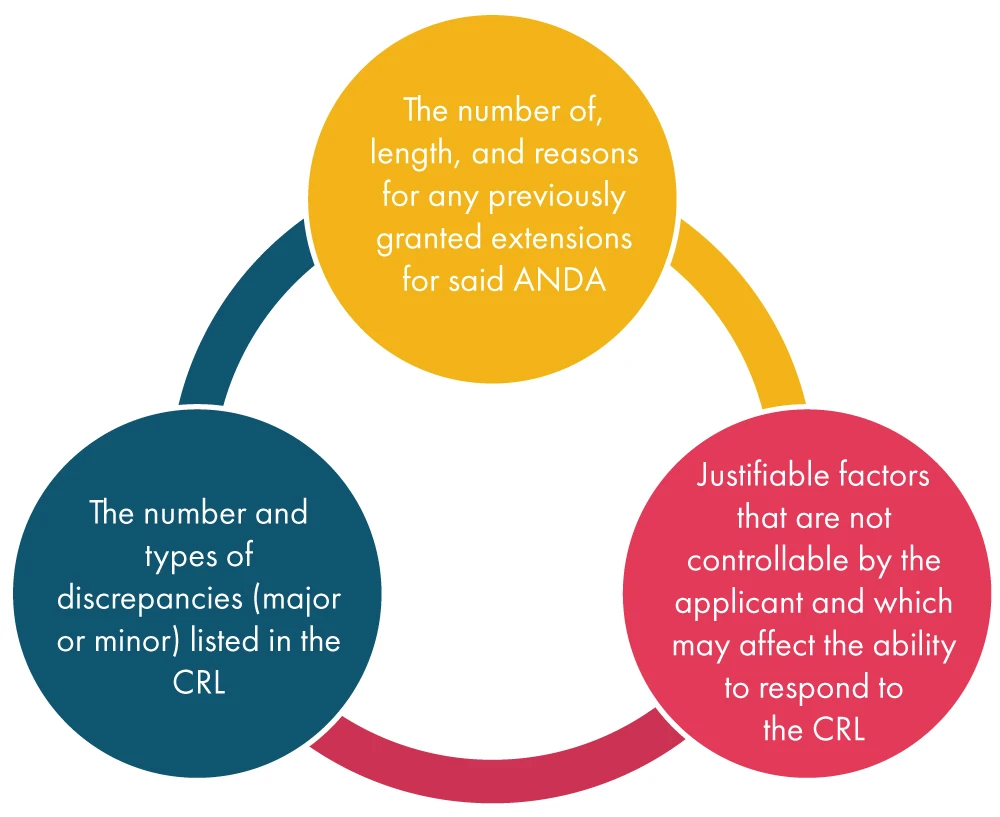
Po FDA wniosku o przedłużenie terminu od wnioskodawcy FDA rozpatruje różne czynniki wymienione poniżej, a następnie podejmuje decyzję w sprawie wniosku:
Czym jest poprawka?
Wnioskodawca musi złożyć wniosek o przedłużenie terminu na udzielenie odpowiedzi na CRL poprzez wprowadzenie poprawki. FDA poprawki jako istotne lub nieistotne w zależności od ich wpływu na proces zatwierdzania.
Ważne FDA , o których wnioskodawcy powinni wiedzieć:
- FDA niewielką zmianę jako znaczącą, jeśli zostanie ona zgłoszona po upływie roku od wydania CRL, chyba że wniosek ANDA produktu znajdującego się na liście leków niedostępnych zgodnie z sekcją 506E ustawy FD&C (21 U.S.C. 356e), lub jest przedmiotem odpowiedzi na stan zagrożenia zdrowia publicznego ogłoszony przez sekretarza US Zdrowia i Opieki Społecznej US zgodnie z sekcją 319 ustawy o służbie zdrowia publicznego (42 U.S.C. 247d), lub w momencie złożenia wniosku ma podlegać tym samym kryteriom, które mają zastosowanie do takiego ogłoszenia.
- Jeśli wnioskodawca nie usunie rozbieżności wskazanych w CRL w przedłużonym terminie przyznanym przez FDA, ta ostatnia może rozważyć wycofanie wniosku ANDA.
- Jeśli wnioskodawca potrzebuje więcej niż trzydziestodniowego (30) przedłużenia terminu, może złożyć wniosek o dalsze przedłużenie. Zmiana musi wówczas zawierać nowe informacje, które pozwolą FDA czy przedłużenie może zostać przyznane, czy nie.
Uzyskanie CRL od FDA być dość trudnym zadaniem dla ANDA . Aby zapewnić szybsze zatwierdzenie leku, należy spełnić wszystkie odpowiednie wymagania, od usunięcia rozbieżności po podanie prawidłowych powodów/informacji uzasadniających przedłużenie terminu. Freyr jest sprawdzonym ekspertem w dziedzinie regulacji, posiadającym rozległą wiedzę na temat reagowania na CRL i zapewniania zgodności z FDA . Skontaktuj się z nami już teraz, aby uzyskać end-to-end wsparcie end-to-end w zakresie ANDA .









