Radiofarmaceutyki to leki zawierające radioizotopy, które są stosowane jako środki diagnostyczne i terapeutyczne. Działają one na określone narządy, tkanki lub komórki w organizmie człowieka. Produkty lecznicze tego typu Produkty lecznicze być podawane doustnie, dożylnie lub śródmiąższowo i stanowią podspecjalizację radioterapii. Obowiązują surowe przepisy dotyczące wprowadzania radiofarmaceutyków do obrotu, ponieważ mogą one być podawane wyłącznie przez specjalistów w dziedzinie medycyny nuklearnej. Jednak możliwości ich zastosowania są ogromne ze względu na ich zdolność do diagnozowania niektórych problemów zdrowotnych lub leczenia chorób, takich jak rak. Globalny rynek radiofarmaceutyków osiągnął wartość około US,9 mld US w 2022 r. i oczekuje się, że do 2030 r. reach wartość 11,93 mldUS, rosnąc w tempie 11,76% (CAGR).
Firmy farmaceutyczne z całego świata starają się zdobyć udział w rynku radiofarmaceutyków, w tym również w Kanadzie. Health Canada HC), kanadyjski Health Authority (HA), znany jest ze swoich wysiłków na rzecz zapewnienia społeczeństwu dostępu do wysokiej jakości usług zdrowotnych. Obowiązują surowe wytyczne/przepisy, które mają na celu zapewnienie bezpieczeństwa pacjentów. Producenci/sponsorzy, którzy chcą wejść na kanadyjski rynek radiofarmaceutyków, muszą zrozumieć przepisy przedstawione przez HC i odpowiednio opracować idealną strategię składania wniosków, aby uzyskać szybsze zatwierdzenie rynkowe.
Regulacyjna mapa drogowa dla zgłoszeń radiofarmaceutyków w Kanadzie
Wszelkie leki sprzedawane w Kanadzie muszą być zgodne z ustawą o żywności i lekach (FDA) oraz przepisami dotyczącymi żywności i leków (FDR). Radiofarmaceutyki są wymienione w załączniku C do ustawy FDA. Dyrekcja ds. Produktów Biologicznych i Terapii Genetycznych (BGTD) HC reguluje dopuszczenie tych produktów do obrotu. Są one dopuszczone do stosowania u ludzi na podstawie pozytywnej oceny bezpieczeństwa, skuteczności i jakości zgłoszonych radiofarmaceutyków.
HC jest oficjalnym członkiem Międzynarodowej Rady ds. Harmonizacji Wymogów Technicznych dotyczących Produktów Leczniczych Stosowanych u Ludzi (ICH). Przyjęła ona ICH dotyczące jakości, bezpieczeństwa, skuteczności i zagadnień wielodyscyplinarnych. Lista tych dokumentów jest dostępna na stronie internetowej HC do wglądu dla sponsorów.
Oprócz wyżej wymienionych dokumentów, wytyczne dla branży: Zarządzanie wnioskami dotyczącymi leków (dokument zawierający wytyczne), ostatnio zaktualizowane 2 sierpnia 2022 r., us informacji us podejścia HC do oceny informacji przedkładanych przez sponsorów dotyczących radiofarmaceutyków. Poniższy wykres (rysunek 1) przedstawia przegląd tematów poruszonych w dokumencie zawierającym wytyczne.
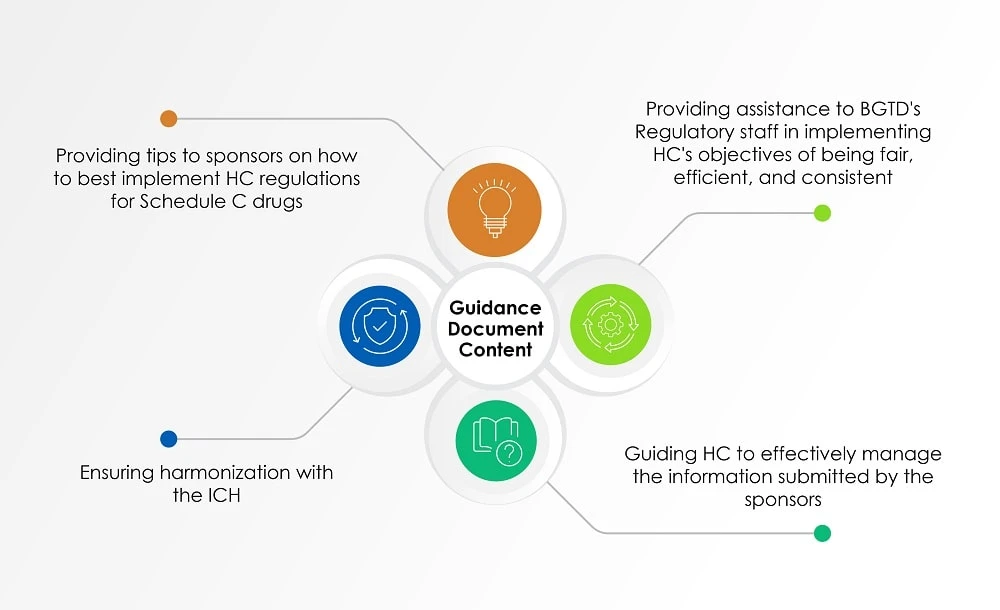
Rysunek 1: Zawartość dokumentu zawierającego wytyczne
Wymogi regulacyjne dotyczące leków z wykazu C są takie same jak w przypadku innych leków. Wymogi te obejmują złożenie wniosku i postępowanie zgodnie z procedurą uzyskania Pozwolenie na dopuszczenie do obrotu produktu leczniczego. Jednakże wymogi dotyczące danych przedkładanych we wniosku różnią się od wymogów dotyczących innych leków ze względu na specyficzne właściwości tych leków.
NDS
Producent leku/sponsor musi złożyć do BGTD dokument New Drug Submission (NDS), który powinien zawierać następujące dane:
- Informacje na temat bezpieczeństwa, jakości i skuteczności leku.
- Raporty/wyniki badań przedklinicznych i klinicznych.
- Informacje na temat wytwarzania leku.
- Szczegółowe informacje dotyczące etykietowania i pakowania.
- Oświadczenia terapeutyczne i potencjalne skutki uboczne leku.
Sponsor może dokonać prezentacji przed BGTD przed złożeniem KDPW. Takie spotkanie przed złożeniem wniosku jest korzystne, ponieważ sponsor może zająć się wszelkimi lukami/pytaniami zgłoszonymi przez BGTD i upewnić się, że wniosek zawiera wszystkie wymagane informacje. Spotkanie powinno odbyć się najlepiej na trzy (03) miesiące przed terminem składania wniosków.
Sponsorzy mogą również rozważyć alternatywne ścieżki przeglądu, takie jak przegląd priorytetowy lub powiadomienie o zgodności z warunkami (NOC/c). Poniżej znajduje się podsumowanie każdej z tych dwóch ścieżek:
- Przegląd priorytetowy: Ta ścieżka ma zastosowanie do NDS lub Suplementu do Zgłoszenia Nowego Leku (SNDS) dla zagrażającej życiu lub poważnie upośledzającej choroby/stanu chorobowego, dla których istnieją wystarczające dowody na skuteczność leku w zakresie diagnozowania, leczenia lub zapobiegania wspomnianemu stanowi chorobowemu. Ma on również zastosowanie w przypadku znacznego zwiększenia skuteczności i/lub znacznego zmniejszenia ryzyka w przypadku choroby, na którą nie ma skutecznego leku na rynku kanadyjskim.
- NOC/c: Ta ścieżka uwzględnia ocenę ryzyka i korzyści leku. NOC/c dotyczy leku, który ma akceptowalny profil bezpieczeństwa dla zagrażającej życiu lub poważnie upośledzającej choroby/stanu. Zezwolenie jest wydawane z pozytywnymi dowodami dla leku radiofarmaceutycznego. Ta ścieżka ma zastosowanie do NDS, SNDS i Abbreviated New Drug Submission (ANDS).
Format NDS
HC przyjęła format elektronicznego Wspólnego Dokumentu Technicznego (eCTD) dla zgłoszeń leków radiofarmaceutycznych. W rzeczywistości dla zgłoszeń radiofarmaceutyków utworzono oddzielne szablony podsumowania informacji o jakości, takie jak QIS-R i QIS-PER.
Wnioski
Podczas gdy HC reguluje dopuszczenie do obrotu radiofarmaceutyków w oparciu o zadowalającą ocenę bezpieczeństwa, skuteczności i jakości złożonych wniosków, Kanadyjska Komisja Bezpieczeństwa Jądrowego (CNSC) reguluje bezpieczeństwo radiacyjne leków radiofarmaceutycznych. CNSC kontroluje takie aspekty, jak obsługa, pakowanie, etykietowanie, przechowywanie, usuwanie itp. materiałów radioaktywnych. Określa również przepisy dotyczące sprzętu używanego do produkcji leków radiofarmaceutycznych.
Zgodność z aktualnymi przepisami HC i CNSC ma zasadnicze znaczenie dla pozytywnej oceny wniosków dotyczących leków radiofarmaceutycznych. Nawiąż współpracę z renomowanym ekspertem ds. regulacji, takim jak Freyr bezbłędną i płynną realizację działań związanych z publikacją i składaniem wniosków w Kanadzie. Bądź na bieżąco! Dbaj o zgodność z przepisami!









