
Większość organizacji zajmujących się naukami przyrodniczymi ma trudności z usprawnieniem procesu składania wniosków regulacyjnych ze względu na częste zmiany wytycznych dotyczących składania wniosków. Według najnowszej analizy przeprowadzonej przez Amerykańską Agencję ds. Żywności i Leków (USFDA) 32% wniosków zawierających dane z badań miało krytyczne problemy z zgodnością danych. Proces ten wymaga dogłębnego zrozumienia współpracy między wewnętrznymi i zewnętrznymi interesariuszami. W ramach organizacji działy produkcji, badań i rozwoju, badań klinicznych/nieklinicznych, QA, marketingu i sprzedaży muszą harmonijnie współpracować, aby przyspieszyć zatwierdzania od początkowego etapu rozwoju do momentu wprowadzenia leku na rynek. Sprawy regulacyjne i organy ds. zdrowia (HA) pozostają w stałym kontakcie, aby zapewnić i ocenić bezpieczeństwo i skuteczność leków przeznaczonych do stosowania u ludzi. Zobaczmy, jakie wstępne działania muszą podjąć organizacje farmaceutyczne, aby osiągnąć doskonałość w zakresie składania wniosków regulacyjnych:
Przydzielanie i wdrażanie zasobów w celu usprawnienia, standaryzacji i przyspieszenia niezorganizowanej pracy związanej z przesyłaniem zgłoszeń.
Specjalista ds. składania wniosków uczestniczy na podstawie umowy i może zrozumieć więcej niż jeden (01) rodzaj wniosku, będąc związanym z programami rozwojowymi przez lata, pomagając w tworzeniu przekonujących narracji do dokumentacji. Ułatwia to organizacjom:
- Eliminacja błędów poprzez zrównoważenie współpracy wewnętrznych i zewnętrznych interesariuszy.
- Skrócenie cyklu przeglądu HA w procesie tworzenia i zatwierdzania dokumentów
- Tworzenie kompletnych i zgodnych z przepisami zgłoszeń, aby nadążyć za zmieniającymi się wymogami regulacyjnymi dla różnych rynków.
- Potwierdzanie zgłoszeń, na które ma wpływ organ regulacyjny
- Bądź na bieżąco ze statusem autoryzacji, przeglądu i zatwierdzania zgłoszeń.
- Ulepszenie obecnego protokołu składania wniosków
Uproszczenie metodologii składania dokumentacji
Tworzenie dossier ma kluczowe znaczenie, jeśli chodzi o przygotowanie zgłoszeń. Zaobserwowano, że wnioski o licencje biologiczne (BLA) i wnioski o nowe leki (NDA) zawierają tony stron, co utrudnia organom regulacyjnym zrozumienie narracji dokumentacji. Posiadanie ustrukturyzowanej reprezentacji ogólnego pomysłu może zwiększyć możliwości zespołu w zakresie przygotowywania zgłoszeń i agencji dokonujących ich przeglądu.
Korzystanie z modułów w celu usprawnienia zgłoszeń umożliwia ekspertom analizę tego, co należy uwzględnić w każdej sekcji lub module dokumentacji. Taka praktyka ułatwia:
- Wczesne rozpoczęcie autoryzacji poprzez przyspieszenie przygotowania zgłoszenia przez organizację
- Wykorzystanie odpowiednich danych wymaganych do tworzenia zgłoszeń
- Wykorzystanie odpowiednich zasobów bez konieczności pisania obszernych dokumentów od podstaw dla każdego zgłoszenia.
Współpraca z organami regulacyjnymi
Każda organizacja musi przeprowadzać regularne spotkania z organami nadzoru w ramach praktyki na wczesnym etapie rozwoju produktu. Zapewnia to terminowy przegląd i informacje zwrotne, co skutkuje przyspieszonym rozwiązywaniem uwag przez organ nadzoru, a w konsekwencji procesem zatwierdzania. Nie tylko buduje to dobre relacje między organizacjami a organami nadzoru, ale także pomaga w uzyskaniu jasności na wczesnym etapie planowania zgłoszenia.
Usprawnienie treści i danych w systemie zarządzania dokumentami (DMS)
Solidne repozytorium treści powinno obsługiwać wszystkie dane z różnych obszarów funkcjonalnych, w tym wcześniej utworzoną dokumentację i informacje. Strukturalna repozytorium treści i danych zapewnia płynny dostęp do dokumentów z różnych obszarów funkcjonalnych bez dodatkowego wysiłku i konieczności powielania. Dokumenty przechowywane w systemie DMS stają się jedynym źródłem informacji dla wszystkich wewnętrznych interesariuszy (nauki kliniczne, CMC, badania niekliniczne, farmakokinetyka, farmakodynamika, pisanie tekstów medycznych i operacje kliniczne). Takie treści i dane mogą być wykorzystywane do tworzenia lokalnych treści w oparciu o regionalne wymagania. Optymalizacja zgłoszeń regulacyjnych poprzez strukturalne zarządzanie treścią i danymi
Przyjęcie technologii i automatyzacji w celu ograniczenia powtarzalnej pracy i błędów.
Organizacje mogą wykorzystać technologię, korzystając z funkcji automatycznej aktualizacji i kontroli jakości tabel, wykazów i rysunków (TLF) w tekście w odniesieniu do danych źródłowych, aby przyspieszyć . W ten sposób, ilekroć wprowadzane są zmiany w istniejących tabelach źródłowych, odpowiednio aktualizowane są również elementy TLF w tekście. Pomaga to wyeliminować ogólną liczbę godzin pracy, zaoszczędzić czas na ścieżce krytycznej i zwiększyć dokładność danych.
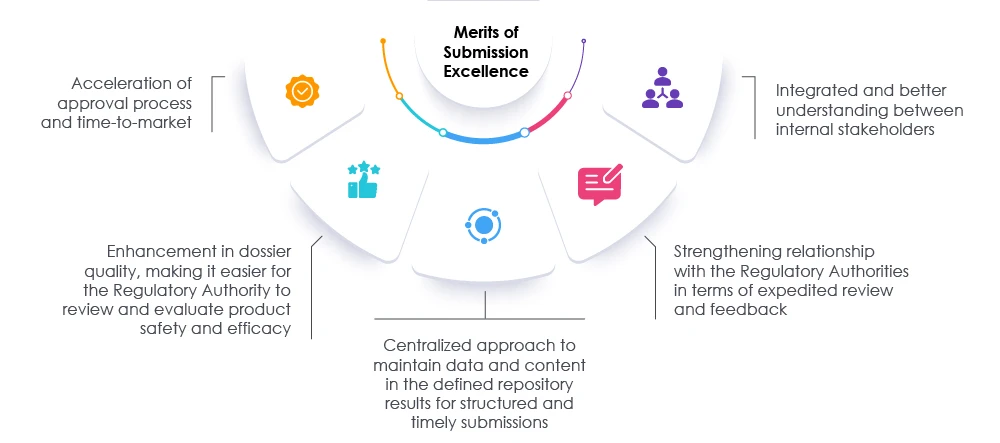
Przyjęcie odpowiednich środków wraz z terminowym przeglądem dokumentacji i danych może pomóc zarówno organom regulacyjnym, jak i organizacjom w przyspieszeniu procesu składania wniosków. Takie podejście skraca czas wprowadzenia produktu na rynek, co pozwala zaspokoić potrzeby zarówno pacjentów, jak i branży. Sprawdzony partner w zakresie regulacji może pomóc organizacjom w ponownym przemyśleniu, ponownej ocenie i modyfikacji obecnych podejść do przygotowywania wniosków. Eksperci Freyr ułatwić osiągnięcie doskonałości w zakresie składania wniosków regulacyjnych poprzez zwiększenie widoczności w całej organizacji i promowanie ogólnej zgodności z przepisami, umożliwiając organizacji odniesienie sukcesu na dzisiejszym rynku nauk przyrodniczych. Skonsultuj się Freyr.









