En los últimos años, la publicidad directa al consumidor se ha convertido en uno de los temas de debate favoritos. A estos anuncios, dirigidos a los consumidores y no a los profesionales sanitarios, se les atribuye el mérito de aumentar la concienciación de los pacientes y la demanda de determinados fármacos. Sin embargo, también se les ha criticado por conducir potencialmente al sobrediagnóstico y al sobretratamiento.
Participando en la actual carrera de tendencias dentro de las empresas farmacéuticas, se sabe que el gasto total en marketing es superior a su presupuesto de investigación. A nivel mundial, se gastaron 1,42 billones de dólares en marketing. En Estados Unidos, se gastaron 486 620 millones de dólares en 2021 para comercializar medicamentos entre los médicos; en Canadá, se gastaron 29 305,1 millones de dólares en 2022. Al desglosar estas cifras, el 56 % correspondía a muestras gratuitas, el 25 % a «detallistas» (promoción directa de medicamentos a médicos) de representantes de ventas farmacéuticas, el 12,5 % a publicidad directa al usuario, el 4 % a detallistas de hospitales y el 2 % a anuncios en revistas2. En ocasiones, las prácticas de marketing negativas pueden afectar tanto a los pacientes como a los profesionales sanitarios.
Tipos de actividades de promoción de medicamentos
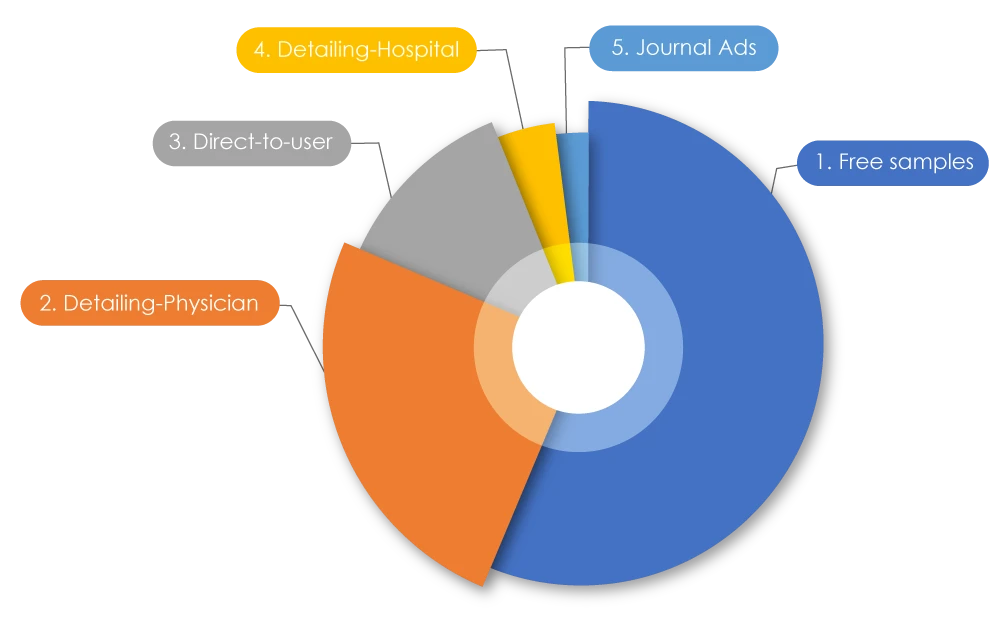
Fuente: Marketing farmacéutico - Wikiwand
Publicidad farmacéutica dirigida al público en general
Se imponen restricciones a la publicidad de medicamentos de venta con receta dirigida al público en general, también denominada comúnmente publicidad directa al consumidor (DTC). Para promocionar medicamentos de venta con receta al público, la comunicación debe cumplir ciertos requisitos fundamentales:
- La coherencia en el etiquetado de la publicidad y la promoción de los medicamentos recetados se basa en el uso previsto para el que el producto ha sido aprobado por la FDA el etiquetado del medicamento FDA). El etiquetado proporciona información sobre cómo utilizar el producto de forma segura y eficaz para la indicación aprobada. La publicidad y la promoción que no sean coherentes con el etiquetado FDA se consideran promociones ilegales «fuera de etiqueta».
- La promoción y publicidad de medicamentos sujetos a prescripción exige un equilibrio justo entre los beneficios y los riesgos del producto, garantizando que dicha información aparezca comparable en profundidad, detalle y contexto.
- Las alegaciones deben estar respaldadas por pruebas o experiencia clínica suficientemente sustanciales
- Veraz y no engañosa - Si la publicidad y promoción de un medicamento de venta con receta es falsa o engañosa en algún aspecto, se considerará que se trata de un medicamento engañoso según la Ley Federal de Alimentos, Medicamentos y Cosméticos (FDCA) y estará sujeta a la aplicación de la ley.
- Utilización de un lenguaje comprensible para el consumidor, evitando el uso de lenguaje técnico, términos científicos y jerga médica en la publicidad y promoción dirigidas al consumidor. Debe atenerse al etiquetado o monografía aprobados del producto.
Información contenida en la publicidad farmacéutica destinada al público en general
La publicidad y promoción de medicamentos recetados dirigida al consumidor debe contener los siguientes elementos básicos, tal y como exigen las regulaciones de la FDCA y la Administración de Alimentos y Medicamentos (FDA).
- Los nombres registrados y establecidos deben ser los especificados en FDA
- Debe incluir la cantidad cuantitativa de ingredientes del medicamento anunciado
- Debe incluir un "breve resumen"que revele cada efecto secundario, advertencia, precaución y contraindicación. Se centra principalmente en la información importante sobre los riesgos, en lugar de ser una lista exhaustiva de los riesgos relacionados con el producto. La mayoría de los riesgos se presentan de la forma más comprensible para los consumidores.
- Los principales riesgos de los productos deben presentarse de forma clara, visible y neutra como una "Declaración principal".
- Las declaraciones de divulgación de información sobre efectos adversos para los anuncios publicitarios dirigidos al consumidor deben incluir la siguiente declaración de MedWatch impresa en texto destacado: «Le animamos a que informe a la FDA sobre los efectos secundarios negativos de los medicamentos recetados. Visite fda o llame al +1–800-FDA-1088FDA
- El etiquetado y la publicidad de recordatorio están exentos de los requisitos generales. Es importante destacar que el etiquetado y la publicidad de recordatorio no están permitidos para los medicamentos recetados que incluyen una advertencia en recuadro en su etiquetado FDA.
Para publicidad directa al consumidor de medicamentos, póngase en contacto con Us.
Para la publicidad directa de medicamentos
Restricciones a las interacciones entre los pacientes o las organizaciones de pacientes y la industria
Las interacciones entre empresas farmacéuticas y pacientes/organizaciones de pacientes sólo están permitidas en unos pocos países, como Estados Unidos, pero con limitaciones, como:
- Debe estar en la etiqueta/CFL
- Justo y equilibrado
- Debidamente justificado y
- Que no sean falsas o engañosas
Además, las interacciones con los clientes no deben implicar la Ley Antisoborno al inducir a las organizaciones de pacientes o a los pacientes a recomendar o utilizar el producto anunciado.
En el Reino Unido, la publicidad directa al público de productos farmacéuticos está permitida, pero excluye a los niños. Está prohibida la publicidad al público de medicamentos sujetos a receta médica. Los anuncios deben incluir el nombre del producto y el nombre del principio activo. No están permitidas las muestras de productos ni los vales que permitan a los consumidores obtener el producto gratis o a un precio irrazonablemente bajo.
En Alemania, solo se permite la publicidad dirigida al público de medicamentos destinados exclusivamente a niños menores de 14 años. Está prohibida la publicidad dirigida al público de medicamentos que solo se pueden adquirir con receta médica. Sin embargo, también existen normas especiales para la publicidad de medicamentos fuera de los círculos profesionales. Estas normas especiales se recogen principalmente en la Ley de publicidad de medicamentos (Heilmittelwerbegesetz, «HWG») y fueron modificadas por la Ley alemana sobre productos farmacéuticos (Arzneimittelgesetz, «AMG») para ajustarse a la Directiva 2001/83/CE4.
Debate sobre la posibilidad de la publicidad de medicamentos en la Era digital
Los defensores de la publicidad directa de medicamentos argumentan que capacita a los pacientes al proporcionarles información sobre las opciones de tratamiento. También señalan que puede provocar un aumento de la demanda de medicamentos, lo que puede ser beneficioso para las empresas farmacéuticas.
Por otra parte, los detractores de la publicidad de medicamentos DTC sostienen que puede conducir a sobrediagnósticos y tratamientos excesivos. Afirman que estos anuncios a menudo exageran los beneficios de los medicamentos al tiempo que restan importancia a sus riesgos, lo que lleva a los pacientes a pedir a sus médicos medicamentos que tal vez no necesiten. Además, afirman que puede provocar un aumento de los costes sanitarios, ya que a los pacientes se les pueden recetar medicamentos de marca más caros en lugar de alternativas genéricas más baratas.
A pesar del debate en curso, la publicidad directa al consumidor de medicamentos ha llegado para quedarse. La FDA publicado directrices para este subtipo de publicidad, que incluyen requisitos para la divulgación de riesgos y un equilibrio justo entre los beneficios y los riesgos. En conclusión, la publicidad directa al consumidor de medicamentos tiene el potencial de educar a los pacientes y aumentar la demanda de ciertos medicamentos. Sin embargo, también es importante tener en cuenta las posibles desventajas y ser consciente de las limitaciones de la información proporcionada en estos anuncios. Como siempre, es importante consultar con su proveedor de atención médica antes de tomar cualquier medicamento. Reach con los expertos de Freyr para obtener end-to-end !