
Introducción
El auge de los productos biofarmacéuticos ha supuesto una auténtica revolución en el ámbito de las ciencias de la vida. Estos fármacos complejos, de moléculas grandes, han transformado el panorama sanitario, ofreciendo tratamientos específicos y eficaces para una amplia gama de enfermedades. A medida que los productos biofarmacéuticos siguen creciendo, la Administración de Alimentos y MedicamentosUS FDA) desempeña un papel fundamental a la hora de garantizar su seguridad y eficacia.
En este blog, profundizamos en el notable auge de los productos biofarmacéuticos y obtenemos información sobre la perspectivaFDA US sobre este campo transformador. Además, comprendemos el papel crucial que desempeñan los proveedores de servicios normativos a la hora de navegar por las complejidades de la normativa biofarmacéutica.
Revolución biofarmacéutica
Debido al auge de la investigación y el desarrollo, la industria biofarmacéutica ha experimentado un notable crecimiento. A diferencia de los medicamentos tradicionales de moléculas pequeñas, los biofarmacéuticos proceden de organismos vivos o procesos biológicos, como proteínas, ácidos nucleicos y células. Estas moléculas grandes y complejas ofrecen varias ventajas, como una gran especificidad y efectos secundarios reducidos, lo que las hace ideales para tratar diversas enfermedades, desde el cáncer hasta los trastornos autoinmunitarios.
La evolución del papel FDA
A medida que florece la industria biofarmacéutica, laFDA US FDA adaptado su enfoque regulatorio para dar cabida a estas terapias innovadoras. La perspectiva de la agencia refleja su compromiso de facilitar la innovación, al tiempo que mantiene los más altos estándares de seguridad para los pacientes.
- Equilibrio entre innovación y seguridad:
Uno de los principales retos FDA en la regulación de los productos biofarmacéuticos es encontrar el delicado equilibrio entre fomentar la innovación y salvaguardar el bienestar de los pacientes. El desarrollo de productos biofarmacéuticos puede ser largo y costoso, y los procesos regulatorios deben ser ágiles para seguir el ritmo de los avances científicos.
- Vías reglamentarias para los productos biofarmacéuticos:
La FDA diversas vías reglamentarias adaptadas a las características únicas de los productos biofarmacéuticos. Esto incluye vías para los biosimilares, que son similares pero no idénticos a los productos biofarmacéuticos ya aprobados, y programas de revisión acelerada para terapias innovadoras que muestran un gran potencial en el tratamiento de enfermedades graves.
- Garantizar la calidad y la eficacia:
La perspectiva FDA sobre los productos biofarmacéuticos se extiende a garantizar la calidad y la eficacia de estos tratamientos. La fabricación de productos biofarmacéuticos es muy compleja y exige un control de calidad riguroso. La FDA estrechamente con los fabricantes para establecer y mantener altos estándares, incluyendo procesos y controles sólidos para minimizar las variaciones en los productos farmacéuticos.
- Control de seguridad y vigilancia posterior a la comercialización:
Más allá de la aprobación inicial, la función FDA en la supervisión de la seguridad y la eficacia de los productos biofarmacéuticos continúa después de su comercialización. Esto incluye la notificación de acontecimientos adversos, inspecciones y evaluaciones de seguridad continuas para identificar y abordar los posibles riesgos. La perspectiva de la agencia está firmemente arraigada en el compromiso de garantizar que los beneficios de los productos biofarmacéuticos sigan superando cualquier riesgo.
- Mantener enfoques centrados en el paciente:
La perspectivaFDA US está en consonancia con la tendencia del sector hacia una asistencia sanitaria centrada en el paciente. Fomenta la participación de las comunidades de pacientes y las partes interesadas en el proceso regulador, garantizando que se escuche la voz de los pacientes y se tengan en cuenta sus necesidades en la evaluación de los productos biofarmacéuticos.
- Fomentar la colaboración mundial:
El auge de los productos biofarmacéuticos ha traspasado las fronteras nacionales. La FDA colabora FDA con organismos reguladores internacionales para establecer directrices armonizadas para el desarrollo biofarmacéutico y la aprobación de estas terapias. Estas colaboraciones contribuyen a agilizar el desarrollo global de los productos biofarmacéuticos, lo que permite que estos tratamientos innovadores sean accesibles a una población de pacientes más amplia.
Papel de los proveedores de reglamentación
Los proveedores de servicios normativos pueden actuar como socios estratégicos en la era los productos biofarmacéuticos, ayudando a las empresas farmacéuticas a navegar por un panorama complejo:
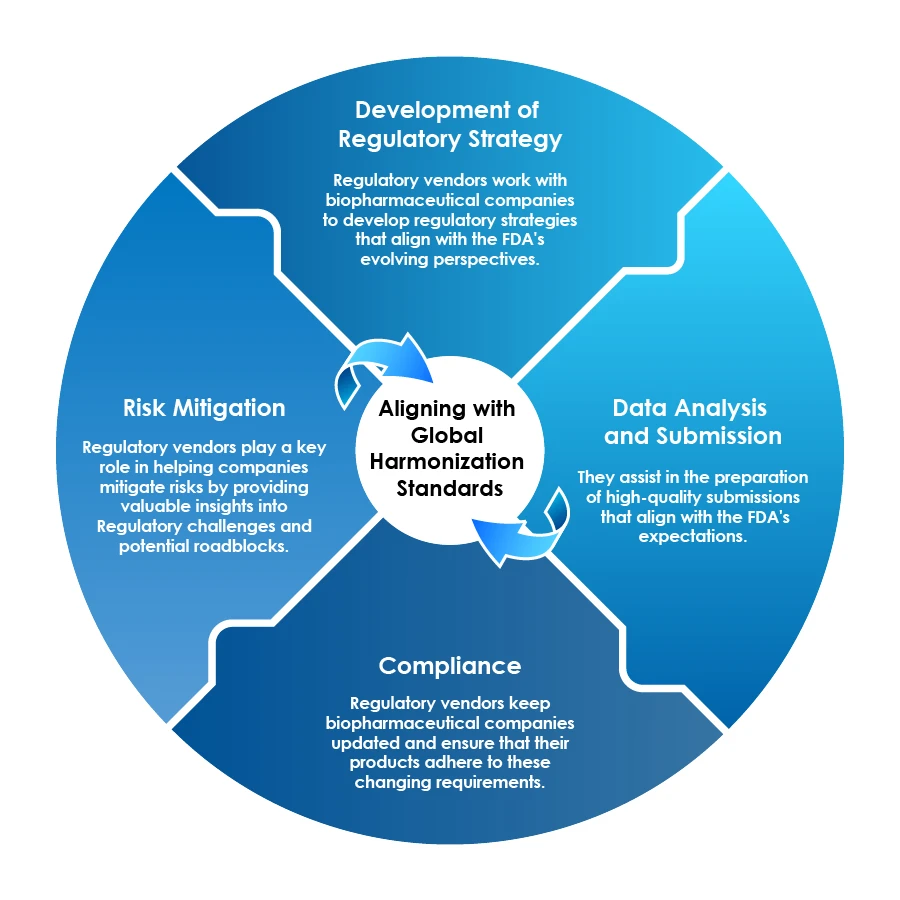
Los proveedores normativos garantizan la conformidad con las normas mundiales
Conclusión
El auge de los productos biofarmacéuticos representa un cambio monumental en la asistencia sanitaria, ya que ofrece tratamientos específicos y eficaces para diversas enfermedades. La perspectiva FDA muestra una adaptación e innovación continuas en los enfoques normativos hacia el desarrollo biofarmacéutico. Además, los proveedores normativos, que actúan como socios cruciales, garantizan que las empresas biofarmacéuticas naveguen con éxito por el complejo panorama, facilitando el camino desde la innovación hasta la disponibilidad en el mercado.
La sinergia entre la FDA los proveedores normativos permite al sector satisfacer las demandas cambiantes de la atención al paciente e impulsar un futuro de innovaciones biofarmacéuticas revolucionarias. Nuestros expertos en Freyr tienen una amplia experiencia en el manejo de estos imperativos normativos. Póngase en contacto con us para obtener más información.









