
Produits médicaux de thérapie avancée Produits médicaux ATMP) représentent une approche médicale de pointe qui exploite le pouvoir des cellules, des tissus ou des gènes pour traiter diverses affections. En raison de leur complexité et de leur nouveauté, les exigences réglementaires applicables Produits médicaux de thérapie avancée Produits médicaux ATMP) sont naturellement strictes. Cela s'étend aux artwork dans les demandes d'autorisation, qui jouent un rôle crucial dans la transmission claire et concise d'informations essentielles.
Lors de l'adaptation artwork réglementaires artwork Produits médicaux de thérapie avancée Produits médicaux ATMP), les considérations suivantes doivent être prises en compte :
Consultez nos Artwork en matière de réglementation Artwork
Demande de consultation
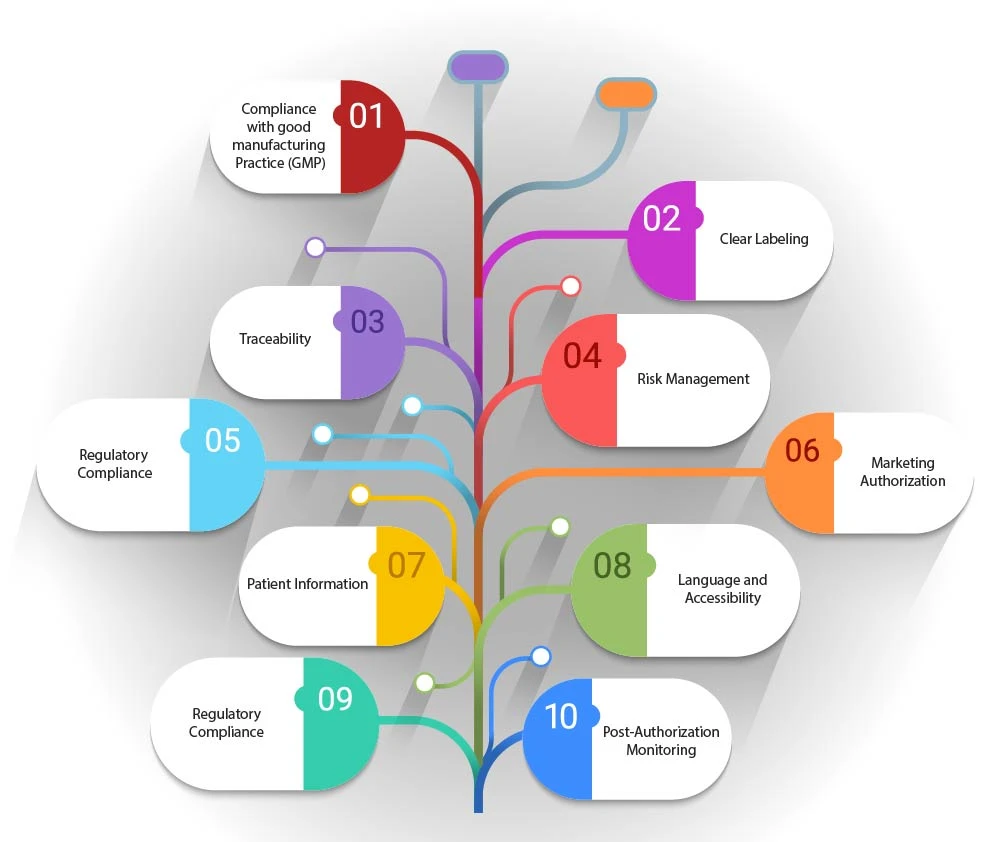
- Conformité aux bonnes pratiques de fabrication (BPF) : les artwork être conformes aux directives BPF spécifiques aux ATMP, qui peuvent inclure des détails sur le processus de fabrication, le contrôle qualité et la traçabilité.
- Étiquetage clair : artwork indiquer la nature du produit, notamment s'il s'agit d'un produit de thérapie génique, de thérapie cellulaire somatique ou de génie tissulaire. Elle doit également mentionner toute exigence spécifique en matière de stockage ou de manipulation.
- Traçabilité : compte tenu de la nature personnalisée de nombreux Produits médicaux de thérapie avancée Produits médicaux ATMP), le artwork faciliter la traçabilité. Cela peut impliquer l'utilisation d'identifiants uniques ou de codes-barres permettant de suivre le produit depuis sa fabrication jusqu'à son administration au patient.
- Gestion des risques : Artwork inclure des informations relatives à la gestion des risques, telles que les effets secondaires potentiels ou les contre-indications, afin de garantir que les patients et les professionnels de santé soient pleinement informés.
- Conformité réglementaire : artwork respecter le cadre réglementaire établi par la législation, notamment le règlement (CE) n° 1394/2007, qui définit les exigences en matière d'autorisation de mise sur le marché, de surveillance et de pharmacovigilance des ATMP.
- Autorisation de mise sur le marché : artwork refléter le statut de l'autorisation de mise sur le marché du produit, qu'il soit entièrement autorisé, en cours d'essai clinique ou soumis à une exemption hospitalière.
- Informations destinées aux patients : Artwork inclure des notices d'information destinées aux patients fournissant des informations complètes sur le médicament de thérapie innovante, son utilisation et toute surveillance pouvant être nécessaire après son administration.
- Langue et accessibilité : artwork être conçue de manière à être accessible et compréhensible, en tenant compte de la langue et de la lisibilité des informations fournies.
- Informations sur les organismes de réglementation : artwork inclure des informations sur les organismes de réglementation compétents, tels que l'Agence européenne des médicaments (EMA) et le Comité des thérapies avancées (CAT), qui sont chargés de l'évaluation et de l'autorisation Produits médicaux de thérapie avancée Produits médicaux ATMP).
- Surveillance post-autorisation : le cas échéant, artwork mentionner toute surveillance post-autorisation ou étude supplémentaire nécessaire pour évaluer la sécurité et l'efficacité à long terme du médicament de thérapie innovante.
L'adaptation artwork réglementaires artwork les ATMP exige une approche méticuleuse, qui concilie exactitude scientifique, communication claire et respect des exigences réglementaires en constante évolution. Si l'expertise interne est précieuse, il peut être extrêmement utile de s'y retrouver dans ce paysage complexe.
C'est là Freyr Solutions le partenariat avec un spécialiste tel que Freyr Solutions . Freyr met à votre disposition une équipe de artwork réglementaires possédant une solide expérience dans le domaine des ATMP. Ils comprennent les défis spécifiques liés aux artwork ATMP artwork possèdent les compétences techniques nécessaires pour créer des visuels clairs, conformes et percutants.
Dans le contexte concurrentiel actuel, une demande réglementaire solide peut faire la différence entre le succès et l'échec. En vous associant à Freyr Solutions, vous vous assurez que votre artwork ATMP met artwork en valeur le potentiel de votre thérapie, ouvrant ainsi la voie à un parcours réglementaire plus fluide. Grâce à ses connaissances spécialisées et à son approche collaborative, Freyr devient un atout inestimable pour commercialiser votre ATMP révolutionnaire. Contactez-nous dès aujourd'hui !









