
Dans le monde de plus en plus complexe de la recherche clinique, les entreprises pharmaceutiques et biotechnologiques font souvent appel à des partenaires externes pour mener des études cliniques. Ces partenariats offrent des avantages considérables, notamment l'accès à une expertise spécialisée, à des technologies de pointe et à une efficacité opérationnelle accrue. Toutefois, pour maximiser ces avantages et garantir le succès des études cliniques, il est essentiel de maintenir une surveillance rigoureuse des demandeurs et des promoteurs. Ce blog explore l'importance de la surveillance du demandeur et du promoteur dans les études cliniques sous contrat et la manière dont elle peut conduire à des résultats de recherche plus fiables et plus significatifs.
Le rôle de la surveillance des demandeurs/parrains :
La surveillance du demandeur/promoteur fait référence à la gestion et à la supervision proactives des études cliniques sous contrat par l'entreprise promotrice.
En quoi consiste la surveillance du demandeur ou du sponsor ?
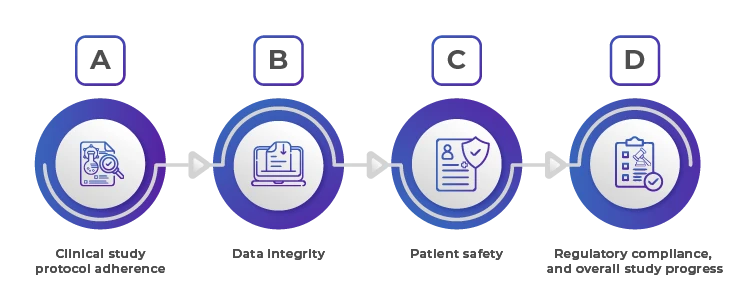
Une surveillance efficace permet de s'assurer que l'étude est menée conformément aux normes et réglementations prédéfinies, ce qui garantit la sécurité, l'intégrité et la confidentialité des données. sécurité, l'intégrité et la validité des résultats de la recherche.
Aspects clés de la surveillance des demandeurs et des promoteurs :
1. Adhésion au protocole de l'étude clinique
Il est essentiel de s'assurer que l'organisation sous contrat respecte le protocole de l'étude à la lettre. Tout écart peut compromettre la validité des résultats de l'étude et entraîner une surveillance réglementaire. Des audits et des visites de contrôle réguliers sont essentiels pour vérifier le respect du protocole. Le promoteur doit fournir des lignes directrices claires et détaillées et organiser des formations périodiques pour s'assurer que toutes les parties prenantes comprennent et respectent le protocole.
- Formation détaillée au protocole : Fournir une formation complète sur le protocole de l'étude à tout le personnel impliqué dans l'étude clinique permet de s'assurer que tout le monde comprend les objectifs, les procédures et les résultats attendus de l'étude. Il s'agit notamment de créer des manuels de formation détaillés et d'organiser régulièrement des séances de remise à niveau.
- Pistes d'audit : L'établissement de pistes d'audit permet de suivre chaque modification apportée au protocole et aux données de l'étude. Cette documentation est essentielle au maintien de la transparence et de la responsabilité, car elle permet d'identifier tout écart par rapport au protocole.
2. Intégrité des données
Des données précises et fiables sont la pierre angulaire de toute étude clinique. Les mécanismes de contrôle doivent inclure des examens réguliers des données, la vérification des données sources et des audits pour garantir que les données sont collectées, enregistrées et rapportées avec précision. Il s'agit également de s'assurer que les systèmes de saisie électronique des données sont validés et sécurisés. La mise en œuvre de pratiques robustes de gestion des données et l'utilisation d'analyses de données avancées peuvent contribuer à la détection précoce des divergences et des anomalies.
- Systèmes de gestion des données : l'utilisation de systèmes sophistiqués de gestion des données qui prennent en charge la saisie, la validation et l'analyse des données en temps réel garantit l'intégrité et l'exactitude des données cliniques. Ces systèmes doivent être conformes aux normes réglementaires telles que 21 CFR Part 11.
- Contrôles de la qualité des données : Des contrôles de qualité réguliers et des processus de nettoyage des données permettent d'identifier et de rectifier toute incohérence ou erreur dans les données, garantissant ainsi que le jeu de données final est fiable et prêt pour l'analyse.
3. Sécurité des patients
La sécurité des participants à l'étude est primordiale. Les promoteurs doivent s'assurer que l'organisation sous contrat dispose de systèmes solides pour surveiller les événements indésirables et mettre rapidement en œuvre des actions correctives. Il s'agit notamment de procéder à des examens réguliers de la sécurité et de veiller au respect des lignes directrices relatives aux bonnes pratiques cliniques (BPC). Des audits de sécurité réguliers, des mécanismes de retour d'information des patients et des outils de surveillance en temps réel sont essentiels pour préserver le bien-être des patients.
- Systèmes de notification des événements indésirables : La mise en place de systèmes efficaces de notification des événements indésirables permet d'identifier et de traiter rapidement les problèmes de sécurité potentiels. Ces systèmes doivent permettre la notification et le suivi immédiats des événements indésirables.
- Technologies de surveillance des patients : Les technologies avancées de surveillance des patients, telles que les dispositifs portables, peuvent fournir des données de santé en continu, ce qui permet d'intervenir à temps et de garantir la sécurité des patients tout au long de l'étude.
4. Conformité réglementaire
Les études cliniques doivent respecter les exigences réglementaires locales et internationales. Une supervision efficace consiste à s'assurer que l'organisation sous contrat respecte ces réglementations et que toutes les approbations et la documentation nécessaires sont en place. Il s'agit notamment de comprendre le paysage réglementaire de chaque région où l'étude est menée et de veiller à ce que toute la documentation soit mise à jour et facilement disponible pour les examens réglementaires.
- Formation réglementaire : La formation continue aux exigences réglementaires dispensée à l'ensemble du personnel de l'étude permet de s'assurer qu'il connaît et respecte l'ensemble des réglementations et des lignes directrices pertinentes.
- Gestion de la documentation réglementaire : La mise en œuvre de systèmes robustes de gestion de la documentation réglementaire garantit que toutes les approbations, tous les rapports et tous les enregistrements requis sont conservés avec précision et sont facilement accessibles en cas d'audit ou d'inspection.
Avantages d'une surveillance efficace des demandeurs/parrains
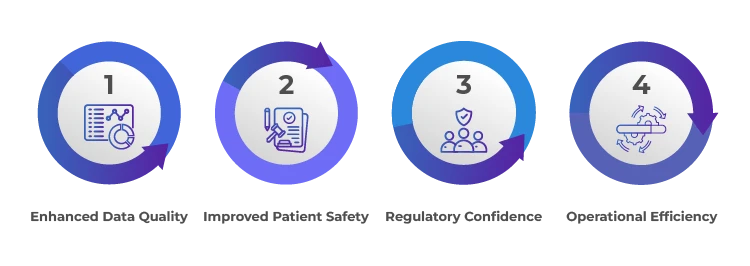
Résumé
La supervision des demandeurs/promoteurs dans les études cliniques sous contrat n'est pas seulement une exigence réglementaire, mais aussi un impératif stratégique. Elle garantit l'intégrité, la sécurité et la fiabilité de la recherche clinique, ce qui se traduit en fin de compte par des résultats d'étude plus solides et plus crédibles. L'expertise d'un partenaire réglementaire en matière de services réglementaires et ses capacités de supervision complètes peuvent vous aider à naviguer dans les complexités des études cliniques, en garantissant que vos recherches sont menées selon les normes les plus élevées. Collaborez avec Freyr améliorer la supervision de vos recherches cliniques et atteindre vos objectifs d'étude en toute confiance.









