
Produkty lecznicze terapii zaawansowanej Produkty lecznicze ATMP) stanowią najnowocześniejsze podejście do medycyny, wykorzystujące potencjał komórek, tkanek lub genów do leczenia różnych schorzeń. Ze względu na ich złożoność i nowatorski charakter, wymogi regulacyjne dotyczące Produkty lecznicze terapii zaawansowanej Produkty lecznicze ATMP) są zrozumiale rygorystyczne. Dotyczy to również artwork w dokumentacji regulacyjnej, która odgrywa kluczową rolę w przekazywaniu ważnych informacji w sposób jasny i zwięzły.
Przy dostosowywaniu artwork regulacyjnej artwork Produkty lecznicze terapii zaawansowanej Produkty lecznicze ATMP) należy wziąć pod uwagę następujące kwestie:
Skonsultuj się z naszymi Artwork regulacyjnej
Poproś o konsultację
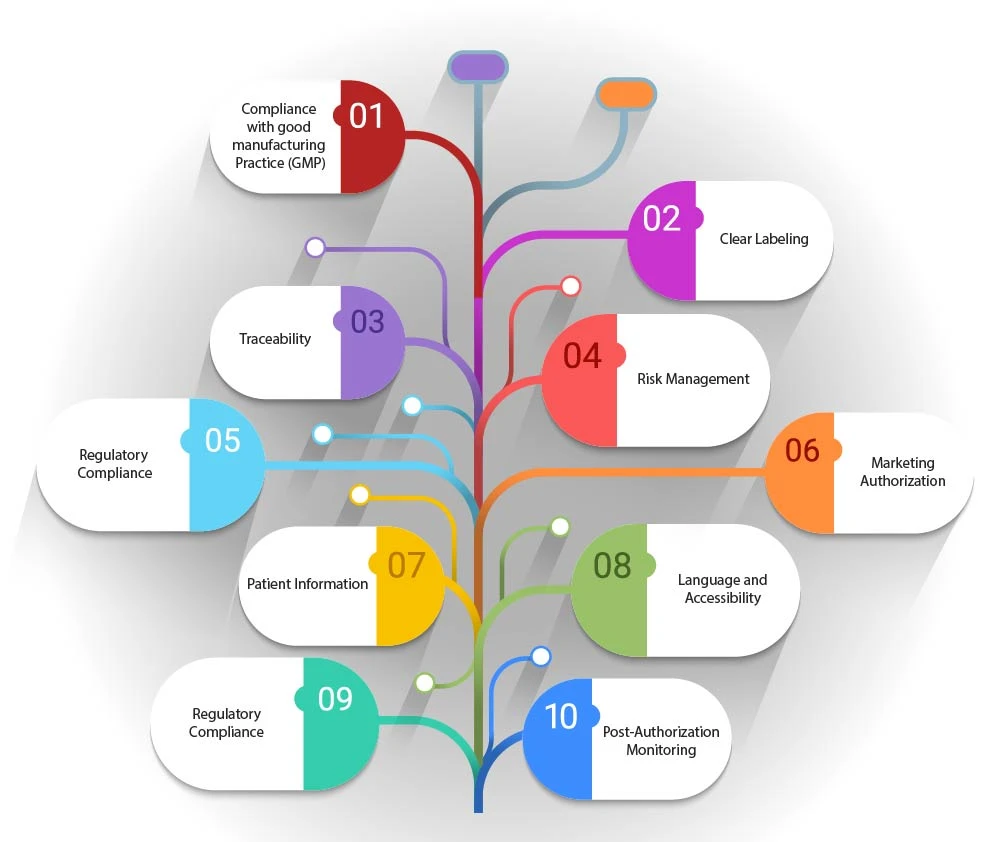
- Zgodność z dobrą praktyką wytwarzania (GMP): artwork być zgodna z wytycznymi GMP dotyczącymi ATMP, które mogą obejmować szczegóły dotyczące procesu produkcji, kontroli jakości i identyfikowalności.
- Jasne oznakowanie: artwork wskazywać charakter produktu, w tym czy jest to terapia genowa, terapia komórkami somatycznymi czy produkt inżynierii tkankowej. Powinna również zawierać wszelkie szczegółowe wymagania dotyczące przechowywania lub obchodzenia się z produktem.
- Identyfikowalność: Biorąc pod uwagę spersonalizowany charakter wielu Produkty lecznicze terapii zaawansowanej Produkty lecznicze ATMP), artwork ułatwiać identyfikowalność. Może to obejmować unikalne identyfikatory lub kody kreskowe, które umożliwiają śledzenie produktu od momentu wyprodukowania do podania pacjentowi.
- Zarządzanie ryzykiem: Artwork zawierać informacje dotyczące zarządzania ryzykiem, takie jak potencjalne skutki uboczne lub przeciwwskazania, aby zapewnić pacjentom i pracownikom służby zdrowia pełną informację.
- Zgodność z przepisami: artwork być zgodna z ramami regulacyjnymi ustanowionymi przez przepisy prawne, takie jak rozporządzenie (WE) nr 1394/2007, które określa wymagania dotyczące Pozwolenie na dopuszczenie do obrotu produktu leczniczego, nadzoru i monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny .
- Pozwolenie na dopuszczenie do obrotu produktu leczniczego: artwork odzwierciedlać status produktu w zakresie Pozwolenie na dopuszczenie do obrotu produktu leczniczego, niezależnie od tego, czy jest on w pełni dopuszczony do obrotu, znajduje się w fazie badań klinicznych, czy też podlega wyłączeniu szpitalnemu.
- Informacje dla pacjenta: Artwork zawierać ulotki informacyjne dla pacjenta, zawierające wyczerpujące informacje na temat ATMP, jego stosowania oraz wszelkich działań monitorujących, które mogą być wymagane po podaniu.
- Język i dostępność: artwork być zaprojektowana tak, aby była dostępna i zrozumiała, z uwzględnieniem języka i czytelności przekazywanych informacji.
- Informacje dotyczące organów regulacyjnych: artwork zawierać informacje o odpowiednich organach regulacyjnych, takich jak Europejska Agencja Leków (EMA) i Komitet ds. Terapii Zaawansowanych (CAT), które są odpowiedzialne za ocenę i zatwierdzanie Produkty lecznicze terapii zaawansowanej Produkty lecznicze ATMP).
- Monitorowanie po wydaniu zezwolenia: W stosownych przypadkach w artwork wspomnieć o wszelkich działaniach związanych z monitorowaniem po wydaniu zezwolenia lub dodatkowych badaniach, które są wymagane w celu dalszej oceny długoterminowego bezpieczeństwa i skuteczności ATMP.
Dostosowanie artwork regulacyjnej artwork ATMP wymaga skrupulatnego podejścia, równoważącego dokładność naukową, jasną komunikację i zgodność z ewoluującymi wymogami regulacyjnymi. Chociaż wiedza specjalistyczna wewnątrz firmy jest cenna, poruszanie się po tym skomplikowanym obszarze może być niezwykle korzystne.
W tym miejscu Freyr Solutions nawiązania współpracy z taką specjalistyczną firmą jak Freyr Solutions . Freyr dysponuje zespołem artwork ds. artwork regulacyjnej, którzy mają bogate doświadczenie w zakresie ATMP. Rozumieją oni specyficzne wyzwania związane z artwork ATMP artwork posiadają umiejętności techniczne niezbędne do tworzenia przejrzystych, zgodnych z przepisami i efektownych materiałów wizualnych.
W dzisiejszym konkurencyjnym środowisku skuteczne zgłoszenie regulacyjne może zadecydować o sukcesie lub porażce. Dzięki współpracy z Freyr Solutions, masz pewność, że artwork ATMP artwork prezentuje potencjał Twojej terapii, torując drogę do sprawniejszej realizacji procedur regulacyjnych. Dzięki specjalistycznej wiedzy i podejściu opartemu na współpracy firma Freyr staje się nieocenionym partnerem w wprowadzaniu na rynek przełomowych produktów ATMP. Skontaktuj się z nami już dziś!









