
La intercambiabilidad con un producto biológico de referencia es un paso crucial en el proceso de aprobación de los biosimilares. Garantiza que un biosimilar pueda sustituir al producto de referencia sin ningún riesgo significativo de reducción de la eficacia o aumento de los problemas de seguridad. Este blog intenta comprender la última FDA sobre las consideraciones para lograr la intercambiabilidad y las mejores prácticas de la industria para alcanzar la excelencia normativa.
Definición de intercambiabilidad
Lograr la intercambiabilidad es un proceso complejo y riguroso que exige cumplir estrictos requisitos reglamentarios. El reto reside en demostrar que el biosimilar no sólo es igual al producto de referencia en términos de seguridad y eficacia sino que también proporciona los mismos resultados clínicos en cualquier paciente. El incumplimiento de estos requisitos puede dar lugar a retrasos o a la denegación de la aprobación, lo que afecta al acceso al mercado y a la atención al paciente.
Requisitos reglamentarios para la intercambiabilidad
La FDA criterios específicos para demostrar la intercambiabilidad en sus documentos de orientación. Estos criterios incluyen:
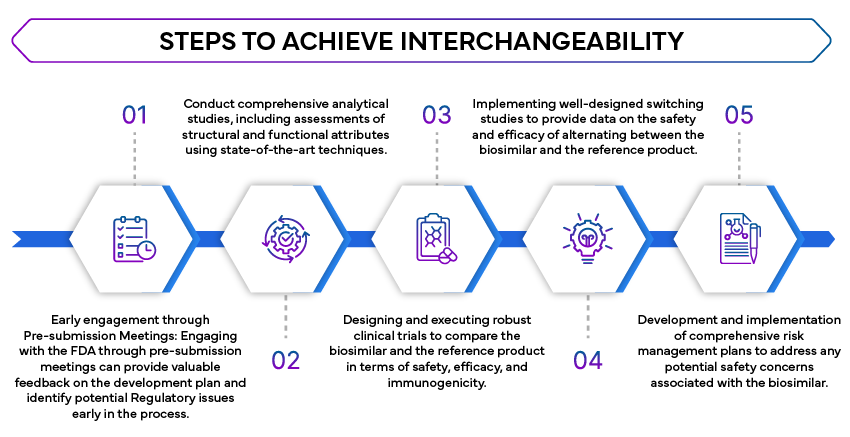
- Estudios analíticos comparativos: Se requieren estudios analíticos exhaustivos para demostrar que el biosimilar es altamente similar al producto de referencia. Estos estudios evalúan la estructura molecular, la función y la composición del biosimilar.
- Estudios clínicos: Los estudios clínicos son necesarios para confirmar que el biosimilar no presenta diferencias clínicamente significativas con respecto al producto de referencia en términos de seguridad, pureza y potencia. Esto suele implicar estudios farmacocinéticos (PK) y farmacodinámicos (PD) comparativos.
- Estudios de cambio: La FDA estudios de cambio para evaluar el impacto de alternar entre el producto biosimilar y el producto de referencia. Estos estudios son cruciales para garantizar que el cambio no afecte a la eficacia o la seguridad del tratamiento.
- Estrategias de Evaluación y Mitigación de Riesgos (REMS): Si procede, deben abordarse las REMS para garantizar que el biosimilar pueda utilizarse indistintamente sin problemas de seguridad adicionales.
Pasos para lograr la intercambiabilidad estratégicamente
Papel de un socio regulador
Las asociaciones reguladoras pueden aumentar significativamente la probabilidad de lograr la intercambiabilidad. He aquí cómo puede ayudar un socio regulador:
- Asesoramiento experto: Ofrece asesoramiento experto sobre los requisitos normativos y las estrategias para cumplir con FDA .
- Apoyo a la documentación: Ayuda en la preparación de documentos de presentación de alta calidad que cumplan las normas reglamentarias.
- Diseño de estudios clínicos: Apoya el diseño y la ejecución de estudios clínicos y de conmutación sólidos.
- Interacciones con la HA: Facilita la comunicación efectiva con la HA, asegurando una retroalimentación oportuna y constructiva.
- Gestión de riesgos: Desarrollar estrategias integrales de gestión de riesgos para mitigar los posibles problemas de seguridad.
Ventajas de contar con un socio regulador
| Ventajas | Descripción | |
| 1. | Experiencia en requisitos reglamentarios | Profundo conocimiento de las normativas y los requisitos mundiales. |
| 2. | Documentación simplificada | Garantiza la preparación precisa y conforme de la documentación. |
| 3. | Proceso de presentación eficaz | Reduce el tiempo y los costes gracias a una gestión eficaz de los envíos. |
| 4. | Cumplimiento reforzado | Minimiza el riesgo de retrasos y rechazos mediante un cumplimiento exhaustivo. |
| 5. | Gestión eficaz del riesgo | Identificación y mitigación proactivas de los riesgos potenciales. |
Resumen
Lograr la intercambiabilidad con un producto de referencia es un proceso exigente pero esencial para la aprobación satisfactoria de los biosimilares. Requiere un conocimiento exhaustivo de los requisitos reglamentarios, una planificación meticulosa y datos clínicos sólidos. Asociarse con un proveedor de servicios regulatorios experimentado puede aumentar en gran medida las posibilidades de éxito, garantizando que el biosimilar cumpla los estrictos criterios establecidos por las autoridades regulatorias. Al aprovechar la orientación de expertos, la documentación exhaustiva y la gestión estratégica de riesgos, los patrocinadores pueden recorrer el complejo camino hacia la intercambiabilidad con mayor eficacia.









