
A medida que nos acercamos al final de 2024, los profesionales del ámbito normativo se encuentran a la vanguardia de innovaciones apasionantes y tendencias desafiantes que están transformando la forma en que se desarrollan, aprueban y supervisan los medicamentos, los dispositivos médicos y los productos biotecnológicos. Este blog explora los últimos avances en Asuntos Regulatorios cómo están transformando el sector.
Además, el rápido avance de la ciencia y la tecnología, junto con las cambiantes expectativas de los pacientes y los retos sanitarios mundiales, ha creado un entorno normativo complejo. Los enfoques tradicionales de Asuntos Regulatorios teniendo dificultades para seguir el ritmo de innovaciones como la inteligencia artificial, la evidencia del mundo real y la medicina personalizada. Tanto los organismos reguladores como las empresas de ciencias de la vida se enfrentan al reto de garantizar la seguridad de los pacientes y la eficacia de los productos, al tiempo que fomentan la innovación y aceleran el acceso al mercado.
Nuevas RA e innovaciones normativas:
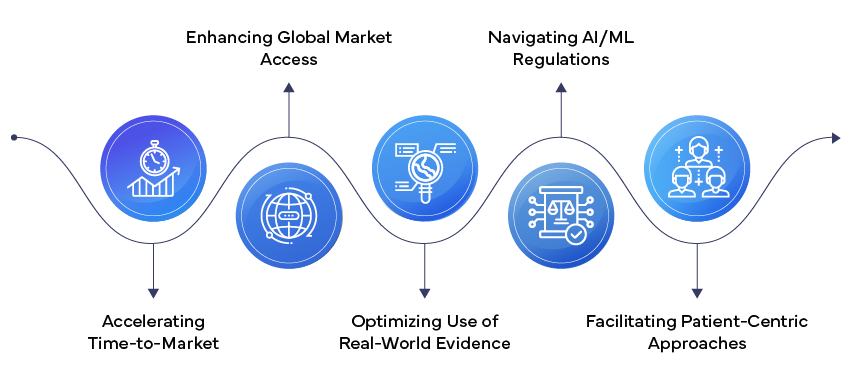
- Inteligencia artificial y Machine Learning: la IA y ML revolucionando Asuntos Regulatorios, desde el modelado predictivo para el diseño de ensayos clínicos hasta la detección automatizada de eventos adversos. El marco recientemente propuesto FDA para el softwareML como Dispositivos Médicos SaMD) señala un cambio hacia enfoques regulatorios más adaptables para estas tecnologías en rápida evolución.
- Integración de la evidencia del mundo real (RWE):Las agencias reguladorasaceptan cada vez más la RWE como apoyo para la toma de decisiones reguladoras. Esta tendencia permite aprobaciones más rápidas y una vigilancia poscomercialización más exhaustiva. La Ley de Curas del Siglo XXI de los US sido un importante impulsor del uso de la RWE en las presentaciones reguladoras.
- Enfoques reguladores centrados en el paciente: Cada vez se hace más hincapié en incorporar las perspectivas de los pacientes en todo el proceso de regulación. Los resultados comunicados por los pacientes y la información sobre sus preferencias se están convirtiendo en parte integrante de las solicitudes de autorización, lo que refleja un cambio hacia procesos de desarrollo y aprobación de medicamentos más centrados en el paciente.
- Vías de aprobación aceleradas: Los organismos reguladores están introduciendo y perfeccionando vías de aprobación aceleradas para agilizar el acceso a terapias innovadoras, especialmente para enfermedades raras y necesidades médicas no cubiertas. La designación de terapia innovadora FDA y el programa PRIME (PRIority MEdicines) EMA son ejemplos de esta tendencia.
- Armonización normativa global: iniciativascomo el Consejo Internacional de Armonización (ICH) están impulsando una mayor armonización de los requisitos normativos entre las distintas regiones, lo que facilita la presentación simultánea de solicitudes a nivel mundial y reduce la carga normativa.
- Regulación de la salud digital: Elauge de las tecnologías de salud digital, incluidas las aplicaciones médicas móviles y los dispositivos portátiles, está impulsando a los organismos reguladores a desarrollar nuevos marcos para evaluar estos productos. El Centro de Excelencia en Salud Digital FDA está a la vanguardia de este panorama regulatorio en constante evolución.
Cuadro: Comparación entre enfoques reguladores tradicionales e innovadores
| Aspecto | Enfoque tradicional | Enfoque innovador |
|---|---|---|
| Fuentes de datos | Principalmente ensayos clínicos | Ensayos clínicos + Pruebas reales |
| Proceso de revisión | Lineal, paso a paso | Adaptativo, continuo |
| Aportaciones de los pacientes | Limitado | Integral durante todo el desarrollo |
| Uso de la tecnología | Análisis básico de datos | AnálisisML |
| Vías de aprobación | Vías estándar | Múltiples opciones de aceleración |
| Estrategia mundial | Región específica | Enfoque global armonizado |
Papel de los expertos en regulación:
En este panorama en rápida evolución, los expertos en regulación desempeñan un papel crucial a la hora de ayudar a las empresas de ciencias de la vida a afrontar retos complejos y aprovechar nuevas oportunidades.
Entre los principales servicios que prestan figuran:
- Planificación estratégica de la reglamentación en consonancia con planteamientos de desarrollo innovadores
- Experiencia en el aprovechamiento deML la inteligencia regulatoria y las presentaciones reglamentarias.
- Orientaciones sobre la integración de la RWE en las estrategias de regulación
- Apoyo a la participación de los pacientes e incorporación de sus puntos de vista
- Navegación por las vías de aprobación acelerada y las iniciativas de armonización mundial
- Experiencia en normativas de salud digital y marcos tecnológicos emergentes
Ventajas de contar con un experto en reglamentación
Asuntos Regulatorios está experimentando una profunda transformación, impulsada por los avances tecnológicos, los enfoques centrados en el paciente y la necesidad de procesos de desarrollo de fármacos más eficientes. A medida que la industria adopta estas nuevas tendencias e innovaciones, el papel de los profesionales de Asuntos Regulatorios se vuelve cada vez más crítico. Al mantenerse a la vanguardia de estas tendencias y aprovechar la experiencia de los socios de Asuntos Regulatorios, las empresas de ciencias de la vida pueden navegar por este complejo panorama de manera más eficaz, llevando terapias innovadoras a los pacientes más rápidamente y manteniendo al mismo tiempo los más altos estándares de seguridad y eficacia. El futuro de Asuntos Regulatorios no Asuntos Regulatorios al cumplimiento normativo, sino que consiste en impulsar la innovación y mejorar los resultados sanitarios a nivel mundial. Haga clic aquí para obtener más información sobre las normativas y las prácticas de cumplimiento.









