En los últimos años, el panorama de Asuntos Regulatorios experimentado una transformación significativa. En el centro de este cambio se encuentra un creciente énfasis en la centralidad del pacientecentrado en el paciente, y las autoridades sanitarias de todo el mundo reconocen el valioso papel que desempeñan los pacientes en el desarrollo y la aprobación de nuevos productos médicos. Este cambio no es solo una tendencia, sino una reinvención fundamental de cómo abordamos las presentaciones reglamentarias y, en última instancia, cómo atendemos a quienes más importan: los pacientes.
El problema:
Tradicionalmente, las solicitudes reglamentarias se centraban principalmente en cumplir los requisitos técnicos y científicos, pasando por alto a menudo el impacto directo en las experiencias y los resultados de los pacientes. Este enfoque, aunque exhaustivo, a veces no logra captar los matices de las necesidades y preferencias de los pacientes, ni el uso real de los medicamentos. Como resultado, existía una desconexión entre las aprobaciones reglamentarias y el valor real que se ofrecía a los pacientes.
Enfoques normativos centrados en el paciente:
Las autoridades sanitarias, en particular la FDA EMA, han dado pasos importantes para incorporar las perspectivas de los pacientes en sus marcos normativos.
Este enfoque centrado en el paciente es evidente en varias áreas clave:
- Desarrollo de fármacos centrado en el paciente (PFDD):
El programa PFDD FDA es una iniciativa pionera que recopila sistemáticamente las opiniones de los pacientes para informar el desarrollo de fármacos y la toma de decisiones reglamentarias. Este programa incluye sesiones para escuchar a los pacientes, reuniones públicas y la elaboración de documentos de orientación para mejorar la participación de los pacientes a lo largo del ciclo de vida del producto. - Pruebas del mundo real:
Cada vez se reconoce más el valor de los datos del mundo real para comprender el rendimiento de un producto en diversas poblaciones de pacientes. Las autoridades sanitarias están ahora más dispuestas a tener en cuenta las pruebas del mundo real en las solicitudes de autorización, ya que ofrecen una visión más completa de los beneficios y riesgos de un producto. - Resultados comunicados por los pacientes (PRO):
La inclusión de PROs en los ensayos clínicos y en las presentaciones regulatorias es cada vez más importante. Estas medidas captan directamente la experiencia del paciente y proporcionan información valiosa sobre los síntomas, la calidad de vida y la satisfacción con el tratamiento. - Participación temprana y asesoramiento científico:
Las autoridades sanitarias están animando a los promotores a participar en las primeras fases del proceso de desarrollo, a menudo incluyendo a representantes de los pacientes en estas conversaciones. Este diálogo temprano ayuda a alinear los planes de desarrollo con las necesidades de los pacientes y las expectativas de las autoridades reguladoras. - Participación de los pacientes en las evaluaciones de riesgos y beneficios:
Tanto la FDA EMA desarrollado marcos para incorporar las perspectivas de los pacientes en las evaluaciones de riesgos y beneficios, garantizando que las decisiones reglamentarias reflejen lo que más importa a los pacientes.
Tabla: Principales iniciativas centradas en el paciente de las principales autoridades sanitarias
| Autoridad sanitaria | Iniciativa | Descripción |
|---|---|---|
| FDA | Desarrollo de fármacos centrado en el paciente (PFDD) | Enfoque sistemático para recabar la opinión de los pacientes |
| EMA | Grupo de Trabajo de Pacientes y Consumidores (PCWP) | Foro de diálogo con organizaciones de pacientes y consumidores |
| MHRA | Participación de pacientes y ciudadanos | Estrategia para implicar a los pacientes en los procesos reguladores |
| Health Canada | Marco de compromiso canadiense en materia de medicamentos y productos sanitarios | Mejora la participación de los pacientes en las actividades reguladoras |
Papel de los proveedores de servicios de regulación:
En este panorama en constante evolución, el papel de Asuntos Regulatorios y socios Asuntos Regulatorios se ha vuelto más crucial que nunca. Actúan como puente entre los patrocinadores, las autoridades sanitarias y los pacientes, garantizando que las estrategias regulatorias se alineen con enfoques centrados en el paciente.
Entre sus principales responsabilidades se incluyen:
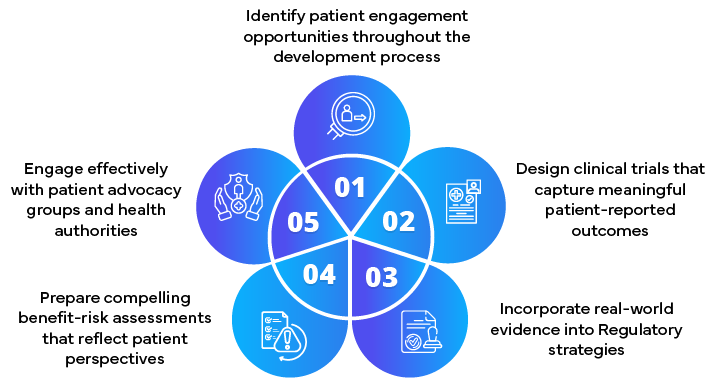
- Desarrollar estrategias de participación de los pacientes
- Incorporación de las aportaciones de los pacientes a los documentos reglamentarios
- Asesoramiento sobre la recogida y presentación de datos centrados en el paciente
- Facilitar un compromiso temprano con las autoridades sanitarias
- Mantenerse al día de la evolución de los requisitos normativos centrados en el paciente
Papel de los socios reguladores en la presentación de solicitudes centradas en el paciente
Resumen:
El cambio hacia un enfoque centrado en el paciente en Asuntos Regulatorios una oportunidad significativa para desarrollar y aprobar productos médicos que realmente satisfagan las necesidades de los pacientes. Al adoptar este enfoque, los patrocinadores no solo pueden navegar por las vías regulatorias de manera más eficaz, sino también ofrecer productos que marquen una diferencia significativa en la vida de los pacientes. A medida que las autoridades sanitarias continúan perfeccionando sus enfoques centrados en el paciente, la experiencia de los proveedores de servicios regulatorios o socios se vuelve invaluable para garantizar que las presentaciones no solo cumplan con los requisitos técnicos, sino que también se identifiquen con las experiencias y prioridades de los pacientes.
En esta nueva era Asuntos Regulatorios, poner a los pacientes en primer lugar no solo es una buena práctica, sino que es la clave del éxito.