
Imaginez que vous travaillez sur un nouveau médicament destiné à traiter une maladie dévastatrice. Après des années de travail acharné, vous avez enfin rassemblé les données nécessaires pour soumettre une demande d'autorisation à la FDA. Mais vous vous rendez compte que vos enregistrements électroniques et vos signatures électroniques ne sont pas conformes à 21 CFR Part 11. C'est un scénario dans lequel personne ne souhaite se retrouver. Le monde de la conformité réglementaire est complexe et en constante évolution. Avec l'introduction constante de nouvelles réglementations, il peut être difficile pour les entreprises de suivre le rythme. Cependant, une réglementation est essentielle pour toute entreprise opérant dans un secteur réglementé : la norme 21 CFR Part 11.
21 CFR Part 11 une réglementation qui établit les critères applicables aux enregistrements électroniques et aux signatures électroniques dans les secteurs FDA. Elle vise à garantir que les enregistrements électroniques sont fiables, sûrs et équivalents aux enregistrements papier et aux signatures manuscrites. 21 CFR Part 11 aux demandes d'autorisation réglementaires, car elle fournit des directives visant à garantir la conformité des enregistrements électroniques et des signatures électroniques aux FDA . Elle est importante car les soumissions réglementaires contiennent souvent une quantité importante de données électroniques, telles que des données d'essais cliniques, des enregistrements de fabrication et des données de contrôle qualité.
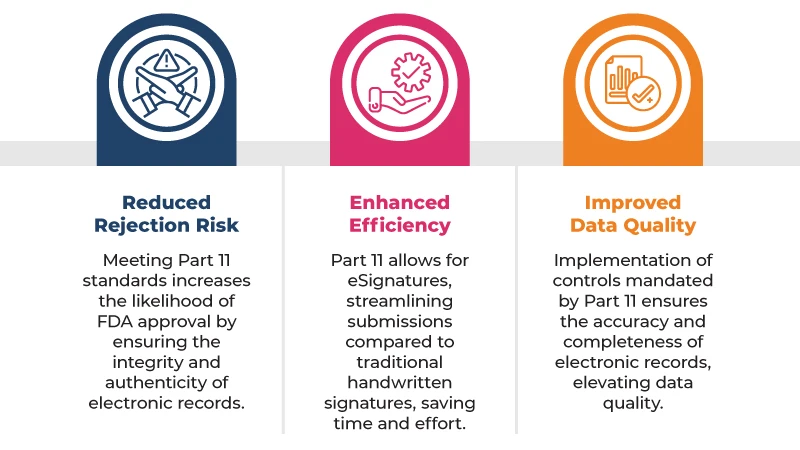
Voici quelques-uns des principaux avantages liés au respect de la norme 21 CFR Part 11 les soumissions réglementaires :
Pour se conformer à la norme 21 CFR Part 11, les entreprises doivent mettre en œuvre un certain nombre de contrôles, notamment :
- Valider les systèmes: S'assurer que les systèmes électroniques répondent aux exigences de la partie 11, y compris une sécurité solide, des pistes d'audit et des tests d'intégrité des données.
- Contrôler l'accès des utilisateurs: Restreindre l'accès au personnel autorisé grâce à la protection par mot de passe, aux signatures électroniques et à d'autres méthodes d'authentification.
- Maintenir des pistes d'audit: Mettre en place des pistes d'audit pour suivre toutes les modifications apportées aux enregistrements, ce qui permet de détecter et d'enquêter sur les modifications non autorisées.
- Assurer la sécurité des données: Employer des mesures de sécurité des données pour protéger les enregistrements électroniques contre l'accès, l'utilisation, la divulgation, la perturbation, la modification ou la destruction non autorisés.
En se conformant à 21 CFR Part 11, les entreprises peuvent contribuer à garantir la fiabilité et la crédibilité de leurs données électroniques issues d'essais cliniques. Cela est important, car FDA sont plus enclins à approuver les demandes réglementaires qui contiennent des données électroniques issues d'essais cliniques de haute qualité.
21 CFR Part 11 est essentielle pour réussir une soumission à la FDA. Et grâce à un logiciel de soumission tel que Freyr PRO, qui centralise la gestion, améliore la collaboration, garantit des soumissions eCTD rapides et est 21 CFR Part 11 , vous pouvez y parvenir. Pour en savoir plus, demandez une démonstration dès maintenant !









