
Les soumissions réglementaires et les tâches de publication ont toujours été laborieuses, impliquant des heures d'efforts manuels pour formater les documents, générer des PDF conformes aux exigences de l'agence, effectuer des contrôles de qualité, assembler les documents pour les soumissions, etc. Les entreprises du secteur des sciences de la vie sont toujours pressées de soumettre leurs dossiers dans les délais impartis, car les échéances sont très serrées. Dans le monde entier, les organismes de réglementation se préparent à adopter des développements récents tels que l'eCTD v4.0 pour les soumissions de dossiers, les amendements et autres rapports. L'eCTD v4.0 est un changement progressif susceptible d'avoir un impact sur l'avenir des soumissions réglementaires, chaque pays se préparant à l'accepter et à le mettre en œuvre.
Compte tenu de tous les défis liés aux soumissions réglementaires, la nécessité d'une solution technologiquement avancée pour stimuler le processus de soumission et d'examen des médicaments s'impose aujourd'hui. Puisque les organisations considèrent déjà l'automatisation comme une partie intégrante du processus de soumission réglementaire, il est crucial d'examiner comment elle peut améliorer la productivité lors de la transition vers l'eCTD 4.0.
Comment l'automatisation facilite-t-elle la transition vers l'eCTD 4.0 ?
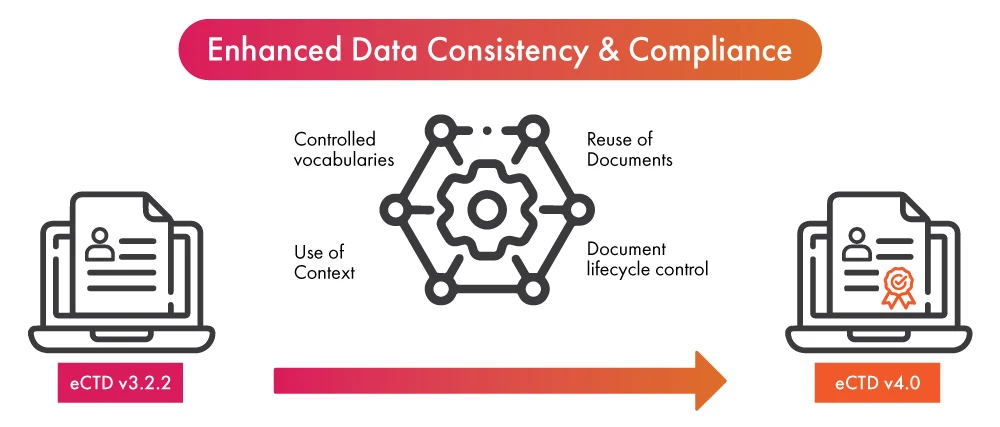
- À l'aube de l'adoption de la dernière version de l'eCTD, le déploiement de l'automatisation dans le processus de soumission réglementaire peut apporter un double avantage aux entreprises des sciences de la vie : d'une part, assurer la conformité à l'eCTD v4.0 dans des délais plus courts et, d'autre part, améliorer la cohérence des données et la rationalisation du processus de soumission.
- Une fois que les données ont été finalisées pour être utilisées dans un (01) dossier réglementaire, l'automatisation permet aux données d'être utilisées dans d'autres soumissions ou mises à jour. Elle tire parti de la nouvelle fonctionnalité de l'eCTD v4.0, qui permet désormais des remplacements de données plusieurs-à-un et plusieurs-à-plusieurs, permettant ainsi la réutilisation des données d'une manière simplifiée.
- Grâce aux notifications automatisées, il n'est plus nécessaire d'envoyer des messages ou de passer des appels téléphoniques lorsque l'activité est requise. Elles permettent une communication plus rapide et plus claire qui débouche sur des vocabulaires contrôlés, un élément essentiel de l'eCTD v4.0.
- L'automatisation de la soumission des documents contribuera à faciliter davantage le processus de mise à niveau du contenu déjà soumis. Elle améliorera le contrôle du cycle de vie des documents soumis.
- L'automatisation des groupes contextuels peut accélérer le processus d'organisation des multiples fichiers destinés à être utilisés pour les soumissions réglementaires.
Dans le cadre de la transition vers la norme eCTD v4.0, il est essentiel pour les organisations du secteur des sciences de la vie de s'associer à des fournisseurs qui sont prêts pour la nouvelle norme et qui comprennent comment automatiser et rationaliser le processus de publication réglementaire. Les entreprises doivent se préparer à adopter les dernières technologies rendues possibles par l'automatisation afin de bénéficier d'avantages considérables et d'un avantage concurrentiel sur le marché. La norme eCTD v4.0 est un changement majeur qui intervient après une longue période. Les organisations doivent commencer leur validation de principe afin de tester le terrain, car cette norme sera bientôt acceptée dans de nombreux pays à travers le monde, en fonction du calendrier de chaque pays.
Chez Freyr , nous Freyr à la pointe de l'innovation technologique et nous sommes prêts à soutenir nos clients en mettant à leur disposition notre logiciel de soumission réglementaire et de publication,Freyr PRO eCTD v4.0.
Pour en savoir plus sur la préparation Freyrà l'eCTD 4.0, veuillezcliquer ici pour télécharger l'enregistrement du webinaire.









