
En plus de remplir les soumissions xEVMPD requises, les organismes spécialisés dans les sciences de la vie devront désormais utiliser un formulaire de demande en ligne appelé Digital Application Dataset Integration (DADI). L'Agence européenne des médicaments (EMA) a conçu le DADI pour remplacer à long terme le formulaire de demande électronique (eAF) au format PDF, qui avait été créé pour prendre en charge les soumissions eCTD.
Le calendrier de cette transition a été récemment publié par EMA. Le formulaire DADI remplacera le formulaire pour les modifications des Produits médicaux 2022. D'autres formulaires de soumission pour les produits autorisés au niveau central (CAP) et les produits autorisés au niveau national (NAP) suivront bientôt en 2023. Le projet remplacera également les formulaires utilisés pour les principales procédures de l'UE, notamment la procédure centralisée (CP), la procédure de reconnaissance mutuelle (MRP), la procédure décentralisée (DCP) et la procédure nationale (NP).
Les formulaires Web (y compris le formulaire HVF (Human Variations Form) pour Produits médicaux à l'usage humain) permettront d'uniformiser les données saisies dans les eAF afin de fournir des données de référence standard pour Produits médicaux. Ils permettront à la fois la sortie lisible par l'homme et la nouvelle sortie lisible par machine pour le traitement numérique, sur la base de la norme d'échange de données Fast Healthcare Interoperability Resources (FHIR) pour Produits médicaux. Ils utiliseront également les données de base existantes des services de gestion des produits (PMS) pour préremplir les champs du formulaire, le cas échéant.
Les formulaires en ligne de la DADI sont destinés à permettre un traitement plus méthodique des demandes, réduisant ainsi la charge de travail de l'organisation. Par exemple, les erreurs et les divergences seront réduites grâce aux formulaires qui permettent aux autorités sanitaires d'examiner les demandes soumises. Les formulaires permettront également d'alimenter les bases de données avec des données de première main, ce qui facilitera l'intégration des systèmes et le partage des données entre les autorités sanitaires. En outre, les nouveaux formulaires remplaceront la technologie archaïque.
Avantages de l'initiative DADI
L'objectif de DADI et de cette transformation des processus réglementaires basée sur les données peut être résumé comme suit :
- Améliorer l'efficacité des fonctions de réglementation, de R&D et de fabrication
- Communiquer plus rapidement avec les autorités sanitaires
- Permettre aux entreprises et aux autorités de prendre des décisions fondées sur des données
- Mieux comprendre et anticiper les résultats de l'entreprise et les performances globales
D'un point de vue global, cela devrait être bénéfique pour les patients, les régulateurs et l'industrie.
Dernières modifications apportées au calendrier par EMA
- La date d'entrée en vigueur des HVF a été repoussée à octobre 2022, alors qu'elle avait été fixée à avril 2022.
- Actuellement, le HVF fait l'objet d'un test d'acceptation par l'utilisateur (UAT) par un groupe composé d'experts en la matière de la DADI.
- Par la suite, un test UAT intégré aura lieu avec un groupe plus large de diverses parties prenantes au cours du deuxième trimestre 2022.
- Une fois qu'il sera opérationnel, il y aura une phase de transition de six (06) mois au cours de laquelle les eAFs (ancienne version PDF) et les formulaires en ligne seront acceptés en parallèle. Ensuite, seule la RPLP sera acceptée.
Veuillez vous reporter à l'infographie suivante pour connaître le calendrier de mise en œuvre du HVF (mis à jour en février 2022, sous réserve de modifications par EMA) :
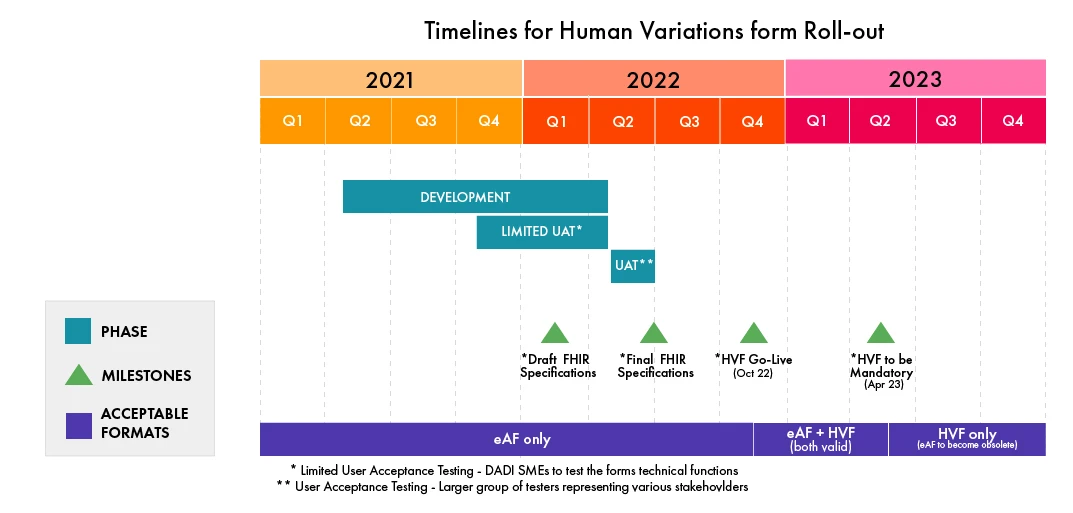
(source : EMA)
Garantir l'adaptabilité à l'environnement réglementaire dynamique
Toutes les grandes autorités sanitaires s'orientent désormais vers la soumission d'ensembles de données et de documents de haute qualité. Il est important que les organisations les conservent dans un système unifié.
Il est également essentiel d'avoir une compréhension claire de l'ensemble du cycle de vie de la soumission - ses exigences, les personnes et les processus qui y sont associés, et le site actuel des données sources par le biais d'une évaluation approfondie des besoins. Le nettoyage et l'enrichissement des données doivent être prioritaires si l'évaluation indique un besoin.
Il est impératif de mettre en place un système de gestion des informations réglementaires (RIMS) qui s'adapte à l'évolution des réglementations et des directives, qui soit suffisamment flexible pour s'adapter aux besoins actuels de l'organisation et qui soit conforme à l'environnement réglementaire dynamique. Pour en savoir plus sur la suite de solutions réglementaires Freyr, qui permettra à votre organisation de se préparer à la DADI et à d'autres changements de processus similaires, us Freyr .









