
L'adoption de la norme eCTD 4.0 représente une étape cruciale vers la modernisation des soumissions réglementaires à l'échelle mondiale. Avec des avantages tels que l'amélioration du suivi des documents et l'optimisation des processus metadata, il n'est pas surprenant que les agences internationales adhèrent à cette évolution.
Mais quelle est EMA ? Contrairement à la FDA, qui a défini des phases de mise en œuvre claires, EMA une approche plus mesurée, en commençant par des programmes pilotes et des évaluations techniques. Dans cet article, nous analysons les projets EMAconcernant l'eCTD 4.0, son impact potentiel sur les dépôts réglementaires et la manière dont votre entreprise peut garder une longueur d'avance.
Plus important encore, EMA a-t-elle déjà EMA l'eCTD 4.0 ? Voyons cela de plus près.
Qu'est-ce que l'eCTD 4.0 et en quoi est-il différent de l'eCTD 3.2.2 ?
L'Electronic Common Technical Document (eCTD) est le format internationalement accepté pour les soumissions réglementaires. Il normalise la manière dont les entreprises pharmaceutiques soumettent les demandes de médicaments et gèrent les mises à jour du cycle de vie sur les différents marchés.
La version actuelle, eCTD 3.2.2, est utilisée depuis des années. Cependant, les organismes de réglementation, dont EMA, travaillent à la mise en place de la norme eCTD 4.0, qui repose sur la norme HL7 (Health Level 7) RPS (Regulated Product Submission). Cette mise à jour améliore l'efficacité des soumissions et la gestion du cycle de vie réglementaire.
Principales différences entre l'eCTD 3.2.2 et l'eCTD 4.0 :
- Meilleure gestion du cycle de vie : Amélioration du suivi des versions des documents et réduction des doublons.
- Granularité plus souple : Permet la réutilisation de documents structurés dans différentes soumissions.
- Metadata améliorée Metadata : metadata plus structurées, facilitant les interactions réglementaires.
- Une plus grande interopérabilité : Conçue pour mieux fonctionner avec les systèmes réglementaires numériques en évolution dans le monde entier.
- Bien que ces changements offrent de nombreux avantages, la transition vers l'eCTD 4.0 nécessite une préparation, un investissement et une compréhension des attentes réglementaires.
Position EMAconcernant l'adoption de l'eCTD 4.0
La grande question qui préoccupe tout le monde est la suivante : EMA a-t-elle EMA du format eCTD 4.0 ? La réponse est non, mais la transition est en cours.
Statut actuel de l'eCTD 4.0 dans l'UE :
- À l'heure actuelle, la norme eCTD 3.2.2 reste la norme obligatoire pour les soumissions dans l'UE.
- EMA activement évalué l'eCTD 4.0, mais n'en a pas officiellement rendu l'utilisation obligatoire.
- L'agence collabore avec d'autres organismes de réglementation, tels que la FDA PMDA japonaise, afin d'harmoniser les normes mondiales.
- Aucune date limite officielle n'a été fixée pour la transition, mais EMA indiqué que l'eCTD 4.0 deviendra à terme obligatoire.
Approche EMA: déploiement progressif avec un programme pilote
Contrairement à USFDA, qui a défini un plan de mise en œuvre par étapes, EMA une approche structurée. L'agence a lancé un programme pilote technique afin de tester la mise en œuvre de l'eCTD 4.0 avec les acteurs du secteur.
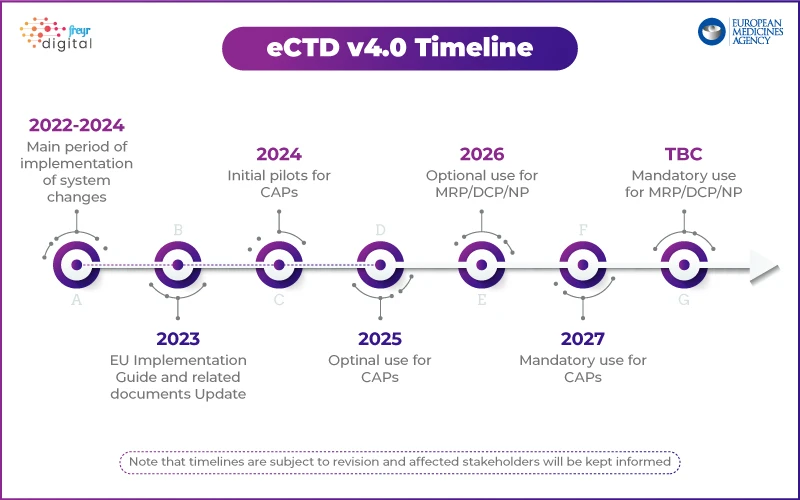
Principaux points forts de la stratégie eCTD 4.0 EMA:
- Étape 1 : se concentrer sur l'interopérabilité technique avec les outils réglementaires.
- Phases futures : Soumissions fictives, gestion du cycle de vie et soumissions groupées.
- Un projet de mise en œuvre est disponible avec des vocabulaires contrôlés et des critères de validation.
EMA à assurer une transition en douceur, et les entreprises du secteur des sciences de la vie sont invitées à suivre les mises à jour sur la page officielle EMA .
Défis et considérations pour les entreprises du secteur des sciences de la vie
Si l'eCTD 4.0 présente des avantages évidents, son adoption n'est pas sans poser de problèmes. Voici quelques éléments clés à prendre en compte par les entreprises pharmaceutiques et biotechnologiques :
- Complexités réglementaires
- La transition progressive EMA signifie que les entreprises doivent se préparer à un double processus de soumission (eCTD 3.2.2 et eCTD 4.0).
- Les délais d'adoption varieront d'une région à l'autre, ce qui obligera les entreprises à rester flexibles.
- Défis techniques
- La migration des données de l'eCTD 3.2.2 vers l'eCTD 4.0 nécessite une planification minutieuse.
- Les règles de validation vont changer de manière significative, ce qui nécessitera la mise à jour des logiciels et des outils.
- Les entreprises doivent investir dans l'automatisation et les solutions pilotées par l'IA pour garantir la conformité.
- Risques de non-conformité
- metadata incorrect metadata ou le non-respect des nouvelles exigences en matière de granularité des documents pourrait entraîner le rejet de la soumission.
- Les équipes chargées de la réglementation ont besoin d'une formation adéquate pour comprendre les nouvelles règles de validation.
- Impact sur les flux de travail existants
- Les entreprises devront adapter leurs processus internes à l'eCTD 4.0.
- Une collaboration accrue entre les équipes chargées de la réglementation, de l'informatique et des soumissions sera nécessaire.
La conclusion principale ? Les entreprises doivent commencer à se préparer dès maintenant, même si EMA pas encore rendu obligatoire l'eCTD 4.0.
Comment les entreprises peuvent se préparer à la transition vers l'eCTD 4.0 EMA
Même si EMA fixé de date limite officielle, les entreprises proactives auront tout intérêt à se préparer dès maintenant. Voici comment :
- Évaluer les processus de soumission actuels
- Identifier les lacunes dans les flux de travail eCTD 3.2.2 existants.
- Évaluer l'impact des nouvelles règles de gestion du cycle de vie sur les demandes en cours.
- Investir dans les bons outils eCTD 4.0
- Choisir un logiciel de soumission réglementaire conforme à la norme eCTD 4.0.
- Assurez-vous que le logiciel prend en charge les normes HL7 RPS et metadata .
- Former les équipes réglementaires et informatiques
- Organiser des ateliers et des sessions de formation sur les changements de l'eCTD 4.0.
- Fournir des directives pour metadata et le suivi du cycle de vie.
- Collaborez avec EMA vos pairs du secteur
- Participez aux programmes pilotes et aux consultations réglementaires EMA.
- Restez informé des dernières recommandations et mises à jour réglementaires EMA.
- Effectuer des essais et des validations
- Effectuer des tests internes en utilisant les structures eCTD 4.0.
- Identifier les problèmes potentiels liés à la granularité des documents et metadata avant la décision finale EMA.
En commençant dès maintenant, les entreprises peuvent assurer une transition en douceur sans perturber les dépôts réglementaires.
Quel est l'avenir de l'eCTD 4.0 en Europe ? L'avenir de l'eCTD 4.0 en Europe
Bien que le calendrier complet de la transition reste incertain, la stratégie à long terme EMA prévoit :
- Standardisation des soumissions sur les marchés mondiaux, améliorant la cohérence et l'efficacité.
- Réduire les délais d'approbation grâce à un meilleur suivi du cycle de vie des demandes.
- Intégrer l'IA et l'automatisation dans les flux de travail réglementaires pour améliorer la conformité.
Au cours des prochaines années, nous pouvons nous attendre à davantage de clarté de la part de EMA, notamment en ce qui concerne les calendriers officiels de transition et les nouveaux critères de validation.
Conclusion
Bien que EMA pas encore rendu obligatoire l'utilisation du format eCTD 4.0, ce n'est qu'une question de temps avant qu'il ne devienne la norme pour les soumissions réglementaires dans l'UE. Les entreprises qui s'y préparent de manière proactive bénéficieront d'un avantage concurrentiel, en garantissant leur conformité et en évitant les obstacles réglementaires de dernière minute.
Principaux enseignements
- L'eCTD 3.2.2 reste la norme actuelle, mais l'eCTD 4.0 se profile à l'horizon.
- EMA une approche progressive, sans mandat officiel pour l'instant.
- Les entreprises doivent commencer à se préparer dès maintenant pour assurer une transition en douceur.
- Il sera essentiel d'investir dans les nouvelles technologies, de former les équipes et de tester les soumissions.
Appel à l'action
Restez informé des annonces réglementaires EMAet commencez à évaluer votre état de préparation à l'eCTD 4.0. Plus vous vous préparerez tôt, plus la transition sera facile lorsque la réglementation entrera en vigueur.
Vous souhaitez obtenir de l'aide pour choisir un logiciel conforme à la norme eCTD 4.0 ou comprendre comment cette transition affecte votre entreprise ? N'hésitez pas à usreach .









