
Le monde des réglementations pharmaceutiques est sur le point de subir une mise à jour majeure avec la mise en œuvre de l'eCTD 4.0. Ce format normalisé promet un parcours plus fluide pour les nouvelles demandes de médicaments soumises aux organismes de réglementation. Mais pour les entreprises qui souhaitent se tailler une part du marché pharmaceutique japonais, qui pèse 141,5 milliards de dollars, il y a un élément crucial : le Japon accélère le calendrier d'adoption !
Voici une analyse de ces faits saillants :
- Adoption obligatoire : Contrairement à d'autres pays qui prévoient des phases volontaires avant l'adoption obligatoire, le Japon vise à rendre obligatoire l'utilisation de l'eCTD 4.0 d'ici à 2026.
- La préparation est essentielle : la préparation est essentielle en raison des contraintes de temps et de l'absence de chemin de migration direct entre PMDA JP1.0 PMDA japonaise et l'eCTD 4.0. Se concentrer sur un meilleur système aidera les entreprises pharmaceutiques japonaises pendant le processus de transition. Ces étapes comprennent la mise à jour des logiciels, la formation du personnel et la préparation de fichiers PDF pour le nouveau format.
- Ressources disponibles : L'Agence japonaise des produits pharmaceutiques et des dispositifs médicaux (PMDA) a publié des ressources destinées à aider les entreprises à s'adapter à ce changement, telles que le « Guide de mise en œuvre de l'eCTD 4.0 (ICH Common Technical Document)ICH », qui explique les modifications apportées et présente les meilleures pratiques disponibles.
Voici quelques raisons pour lesquelles vous ne devriez pas manquer ce jeu de chiffres :
- Accélération vers l'eCTD 4.0 : contrairement à d'autres régions où le processus est progressif, le Japon vise une adoption obligatoire de l'eCTD 4.0 dès 2026, soit trois ans avant la date limite fixée parFDA US FDA 2029 ! Avec un calendrier aussi ambitieux, le Japon prend ainsi les devants en matière d'intégration mondiale de l'eCTD.
- Pas de droit à l'erreur : Contrairement aux versions précédentes, le JP ne peut pas être converti directement en eCTD 4.0. Cela signifie que les entreprises pharmaceutiques doivent être particulièrement bien préparées afin d'éviter tout retard dans la soumission, ce qui pourrait leur coûter des millions de dollars de recettes.
- Une aide précieuse pour un atterrissage en douceur : l'Agence japonaise des produits pharmaceutiques et des dispositifs médicaux (PMDA) comprend les défis à relever. Elle a mis au point des ressources telles que des guides de mise en œuvre conçus pour aider les entreprises à s'adapter facilement à ces modifications et à s'implanter avec succès sur le marché japonais. (pmda).
Si vous développez des médicaments pour l'énorme marché japonais, il est temps de vous mettre au travail ! Voici votre liste de contrôle avant le vol :
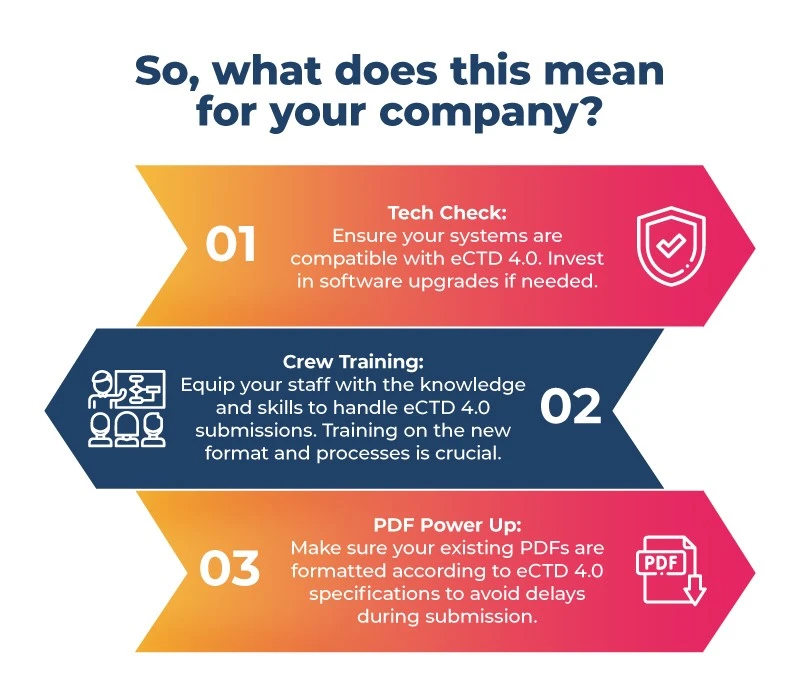
Le passage à l'eCTD 4.0 promet une efficacité accrue et une normalisation mondiale tout au long du processus d'autorisation des médicaments. Votre entreprise peut anticiper cette évolution au Japon afin d'assurer une transition en douceur et de profiter des innombrables opportunités offertes par cette nouvelle era. N'oubliez pas que ne pas se préparer, c'est se préparer à échouer. Soyez donc prêt à prendre votre envol avec l'eCTD 4.0 au Japon.
Les avantages et les opportunités acquis sont intéressants pour l'industrie pharmaceutique. Cependant, ce processus comporte son lot de difficultés qui doivent être résolues. Afin de naviguer sans encombre dans un environnement réglementaire en constante évolution, les entreprises peuvent rechercher des partenariats avec des consultants fiables tels que Freyr. Embrasser l'avenir des soumissions réglementaires au Japon avec notre logiciel eCTD inégalé, Freyr SUBMIT PRO, qui est conforme 21 CFR Part 11 et dispose d'un modèle de déploiement flexible. us pour en savoir plus et vous lancer dans une aventure vers une efficacité et un succès accrus. Demandez une démonstration dès aujourd'hui.









