Les coûts de mise en conformité des entreprises pharmaceutiques peuvent représenter jusqu'à 25 % de leurs dépenses opérationnelles totales. Les entreprises pharmaceutiques qui possèdent de multiples portefeuilles de produits sont confrontées à des défis uniques en matière de gestion de la conformité mondiale, de suivi des soumissions de dossiers et de supervision des variations d'étiquetage. La complexité des exigences réglementaires dans les différentes régions, associée au traitement manuel de grandes quantités de données, peut conduire à la non-conformité, à des retards dans les autorisations de mise sur le marché et à des inefficacités opérationnelles.
Ce blog explore les principaux défis que rencontrent les entreprises pharmaceutiques lorsqu'elles gèrent de multiples portefeuilles de produits et montre comment les logiciels de réglementation, étayés par des études de cas réels, offrent une solution stratégique à ces problèmes.
Principaux défis liés à la gestion de portefeuilles de produits multiples
- Exigences complexes en matière de conformité mondiale : chaque pays dispose de son propre organisme de réglementation, et leurs exigences peuvent varier considérablement. Par exemple, laFDA US , EMA et PMDA japonaise PMDA des formats de soumission, des délais et des normes de conformité différents. Les entreprises pharmaceutiques doivent gérer divers dossiers dans plusieurs régions tout en veillant à ne pas déroger aux réglementations locales.
- Suivi des variations d'étiquettes d'une région à l'autre : La gestion des variations d'étiquetage pour les différentes régions et la garantie de mises à jour en temps utile constituent l'un des aspects les plus difficiles de la gestion de portefeuille. Une mauvaise gestion des changements d'étiquettes peut entraîner une non-conformité, des rappels de produits et d'importants revers financiers.
- Surcharge des dossiers à soumettre : La soumission et la gestion de dossiers pour plusieurs lignes de produits, chacune à un stade de développement différent, peuvent rapidement submerger les équipes internes. Le traitement manuel des mises à jour du cycle de vie des produits entraîne souvent des erreurs et des retards d'approbation.
- Mauvaise gestion des ressources : Les équipes ont souvent du mal à allouer les bonnes ressources de manière efficace. Sans un système de gestion solide, les entreprises risquent de surcharger leur personnel de tâches administratives, limitant ainsi leur capacité à se concentrer sur les activités stratégiques essentielles.
- Silos de données : l'absence de centralisation signifie que les données relatives aux soumissions, aux approbations et aux mises à jour des produits sont stockées dans des systèmes disparates, ce qui entraîne des inefficacités, des erreurs de communication et des difficultés à maintenir une vue d'ensemble du cycle de vie des produits.
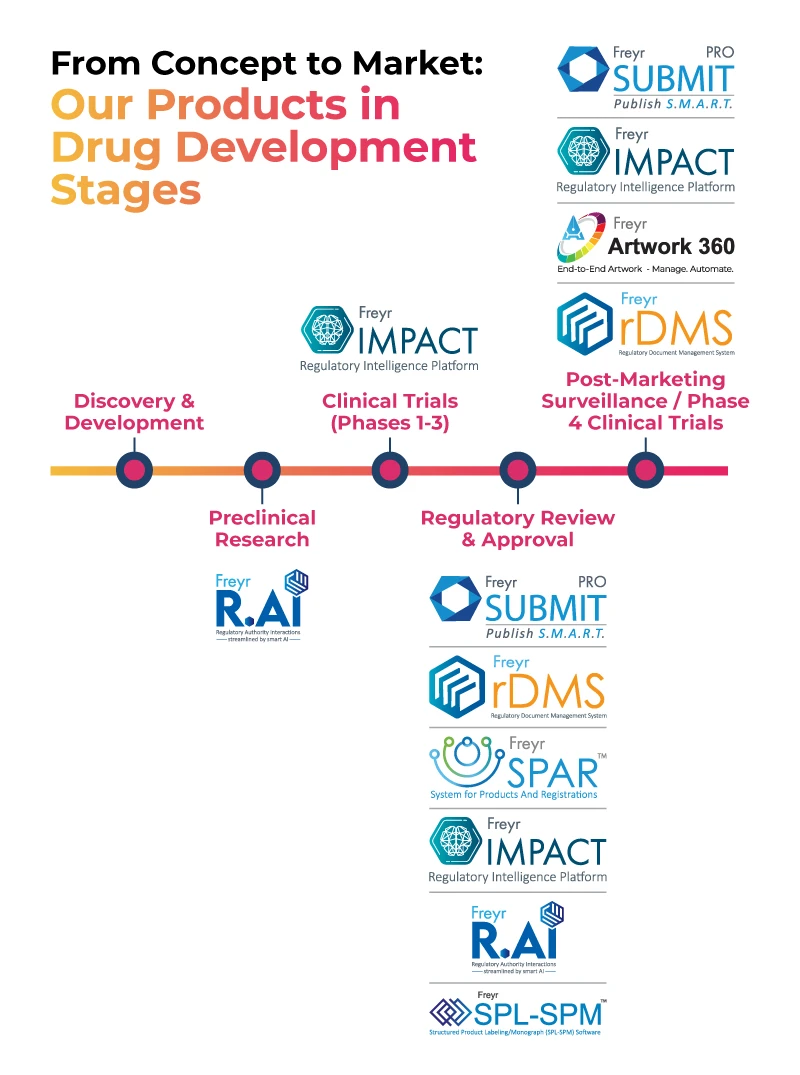
La gamme de produits technologiques Freyr accompagne les entreprises pharmaceutiques tout au long du processus, de la conception à la commercialisation, comme le montre l'image ci-dessous.
Études de cas : Comment les logiciels de réglementation procurent un avantage stratégique
En adoptant des logiciels réglementaires, les entreprises pharmaceutiques peuvent automatiser leurs processus, garantir la conformité et, en fin de compte, acquérir un avantage stratégique sur leurs concurrents. Les études de cas suivantes mettent en lumière des exemples concrets de la manière dont nos solutions logicielles réglementaires ont aidé les entreprises pharmaceutiques à relever ces défis.
Cas avéré
Le défi du client
Une société pharmaceutique générique US avait du mal à gérer efficacement ses soumissions end-to-end et ses documents end-to-end . Elle était confrontée à des difficultés liées à la dispersion des référentiels de documents, ce qui rendait difficile l'accès transparent aux documents réglementaires pour les parties prenantes internes et externes. De plus, le processus de création et de gestion Structured Product Labeling (SPL) fastidieux, ce qui entraînait des retards dans les délais de soumission et allongeait les cycles de révision.
La solution Freyr
Freyr est intervenu en tant que fournisseur de solutions virtuelles pour les affaires réglementaires, déployant ces trois produits clés comme solutions pour relever les défis du client :
- Freyr : un système centralisé de gestion des documents qui sert de source unique de vérité pour toutes les soumissions réglementaires et tous les documents, garantissant un accès en temps réel et un contrôle des versions tant pour les équipes internes que pour les partenaires externes.
- Freyr PRO: un outil puissant pour la publication et la soumission eCTD, qui rationalise le processus de soumission, réduit le temps de préparation et garantit la conformité aux normes réglementaires en constante évolution.
- Freyr : une solution efficace pour gérer toutes les activités liées au SPL, améliorant considérablement les processus de création, de gestion et de soumission de documents.
Résultats
En mettant en œuvre ces solutions, Freyr a aidé le client à atteindre les objectifs suivants :
- une réduction de 30 % du temps de préparation des demandes
- Respect à 100 % de toutes les exigences réglementaires
- Une amélioration de 40 % de l'efficacité du traitement des documents
- Une réduction de 25 % des cycles de révision
Conclusion : La transformation numérique au service de la réussite stratégique
Gérer de multiples portefeuilles de produits sur les marchés mondiaux n'est pas une mince affaire. Cependant, avec le bon logiciel réglementaire, les entreprises pharmaceutiques peuvent rationaliser les processus, garantir la conformité et acquérir un avantage stratégique dans l'industrie.
La suite d'outils réglementaires Freyr , notamment Freyr PRO, Freyr et Freyr ont toujours aidé les entreprises pharmaceutiques à réduire les délais de soumission, à améliorer la conformité et à optimiser les ressources. En automatisant les processus manuels, en centralisant la gestion des données et en offrant des informations en temps réel, nos solutions permettent aux entreprises pharmaceutiques de rester en tête dans un marché concurrentiel. us.









