
L'industrie pharmaceutique chinoise a connu une croissance substantielle depuis son entrée dans l'Organisation mondiale du commerce (OMC). En 2021, la Chine détiendra une part de 12 % du marché pharmaceutique mondial, ce qui en fait le deuxième contributeur le plus important. Selon l'agence de presse Xinhua, le marché pharmaceutique chinois générera 708,75 milliards de yuans en 2021, tandis que les entreprises pharmaceutiques nationales chinoises réaliseront 502 milliards de dollars de bénéfices.
Comme vous le savez peut-être, l'Administration nationale des produits médicaux (NMPA), l'autorité sanitaire chinoise, a commencé à accepter les demandes d'autorisation de mise sur le marché (AMM) au format eCTD ainsi que les demandes d'essais cliniques (CTA), ouvrant ainsi la voie à de nouvelles opportunités. Cependant, cela s'accompagne d'un certain nombre de défis.
Dans ce blog, nous examinons le monde des soumissions électroniques de documents techniques communs (eCTD), qui deviennent rapidement la méthode de référence pour les soumissions de documents dans l'industrie pharmaceutique.
Défis rencontrés par les entreprises chinoises pour s'adapter aux soumissions eCTD obligatoires
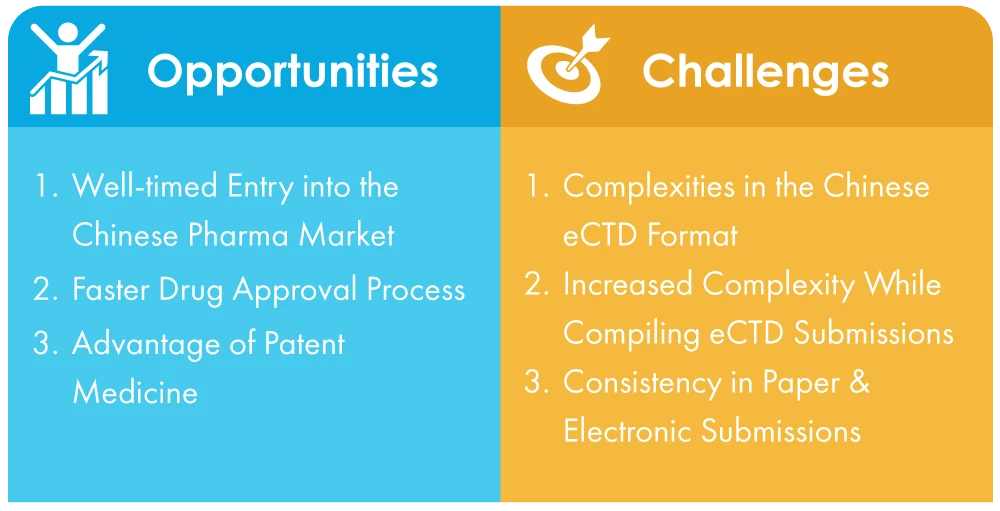
- Complexité du format eCTD chinois : Contrairement à la norme universelle, qui est assez simple, le format eCTD chinois est compliqué et peut être difficile à passer pour les entreprises qui ne sont pas familiarisées avec le processus. Cela peut entraîner des retards dans la présentation des références essentielles.
- Complexité accrue lors de la compilation des soumissions eCTD : NMPA, l'autorité sanitaire chinoise, a mis en place de nouvelles règles et réglementations pour faciliter la transition vers les soumissions électroniques, mais les entreprises doivent encore composer avec un environnement complexe et dynamique. Cela peut s'avérer plus difficile pour les entreprises qui ne sont pas présentes localement ou qui ne maîtrisent pas parfaitement l'écosystème réglementaire chinois.
- Assistance multilingue pour les soumissions papier et électroniques: Les documents doivent être soumis en mandarin avec les versions anglaises comme référence, ce qui peut être une tâche difficile pour les entreprises qui n'ont pas d'affiliations avec des traducteurs qualifiés.
Possibilités offertes par le passage du papier à la dématérialisation des soumissions
- Une entrée opportune sur le marché pharmaceutique chinois : L'entrée sur le marché chinois est devenue plus facile grâce aux réformes transformatrices et aux améliorations politiques mises en œuvre. L'un des principaux changements est l'adoption des soumissions électroniques, qui rationalise le processus et élimine de nombreux défis auxquels les entreprises étaient autrefois confrontées. Cela témoigne de l'engagement de la Chine à promouvoir les ajustements structurels, les transformations procédurales et la croissance globale du marché.
- Processus d'approbation des médicaments plus rapide : Maintenant que les soumissions sont devenues électroniques, le processus d'approbation des médicaments sera beaucoup plus rapide et, par conséquent, le processus de mise sur le marché des médicaments sera plus fluide et plus rapide. Cela permettra aux grandes entreprises pharmaceutiques d'accroître la part de la Chine sur le marché pharmaceutique mondial.
- Avantages des médicaments brevetés : Les médicaments brevetés constituent le deuxième segment de produits par ordre d'importance, avec des marges bénéficiaires importantes. Toutefois, la fabrication de médicaments princeps implique de longues périodes de retour, des coûts de recherche et développement élevés et des périodes de recherche et développement prolongées. Avec la mise en œuvre des soumissions électroniques, tous ces obstacles peuvent être surmontés. En 2022, les entreprises étrangères resteront les principaux acteurs de ce marché. Il s'agit donc d'un marché de niche pour ce segment.
Comment se préparer à cette nouvelle mise en œuvre en Chine ?
Le passage à la soumission obligatoire des dossiers eCTD en Chine offre de nombreuses opportunités aux entreprises qui souhaitent rester compétitives sur le plus grand marché pharmaceutique mondial. En s'associant avec le bon expert, les entreprises peuvent naviguer avec aisance et confiance dans un paysage réglementaire en constante évolution. Pour garder une longueur d'avance, il est essentiel de disposer d'une filiale présente localement et connaissant bien les réglementations de la HA. Freyr SUBMIT PRO, un logiciel de publication et de soumission, aide les fabricants à pénétrer facilement le marché pharmaceutique chinois. Pour en savoir plus sur cet outil, demandez une démonstration.









