
L'idée de soumettre électroniquement les demandes d'autorisation de mise sur le marché des produits pharmaceutiques est antérieure à l'outil eCTD lui-même. À la fin des années 1980, des initiatives telles que CANDA (Computer-Aided New Drug Application) ont été étudiées par laFDA Food and Drug Administration) US et les agences européennes. Ces premières initiatives visaient à améliorer l'efficacité et l'accès aux données pour les évaluateurs.
Entrez la norme eCTD (2003) :
En 2003, la Conférence internationale sur l'harmonisation (ICH) a introduit une véritable révolution : la norme eCTD (electronic Common Technical Document, ou document technique commun électronique). Ce format normalisé a été conçu pour établir un langage universel pour les soumissions électroniques à travers le monde.
L'émergence des outils eCTD :
Avec l'adoption de la norme eCTD, la demande d'outils eCTD spécialisés a explosé. Ces outils ont apporté plusieurs avantages essentiels :
- Rationalisation de la création de contenu : Les utilisateurs peuvent créer et organiser facilement des documents conformes à la structure de l'eCTD.
- Validation robuste : les outils eCTD ont permis de s'assurer que les soumissions étaient conformes aux spécifications techniques, évitant ainsi les retards dus à des erreurs de formatage.
- Gestion efficace du cycle de vie : La gestion des révisions, le suivi des versions et le maintien de la conformité réglementaire sont facilités.
Ces innovations ont révolutionné le processus de soumission réglementaire, le rendant plus efficace et plus fiable.
Comment le logiciel Freyr automatise la création d'eCTD
La solution logicielle avancée Freyr , Freyr PRO, relève ces défis en automatisant les aspects clés de la création d'eCTD, améliorant ainsi l'efficacité et réduisant les erreurs humaines.
Optimisation des ressources: En automatisant les tâches répétitives, notre logiciel libère des ressources humaines précieuses. Les professionnels peuvent se concentrer sur des activités plus stratégiques et à plus forte valeur ajoutée, telles que l'analyse des données, l'élaboration de stratégies réglementaires et l'engagement des parties prenantes. Cette évolution permet non seulement d'améliorer la productivité, mais aussi de réduire les coûts opérationnels, ce qui se traduit par un retour sur investissement significatif.
Risque d'erreur humaine minimisé: L'automatisation réduit le risque d'erreur humaine en garantissant que les données sont transférées avec précision et que les documents sont correctement formatés. Les contrôles de validation intégrés au logiciel et les mécanismes de détection des erreurs améliorent encore la qualité et la conformité des soumissions réglementaires. Cela réduit la nécessité de retravailler et contribue à garantir des approbations en temps voulu.
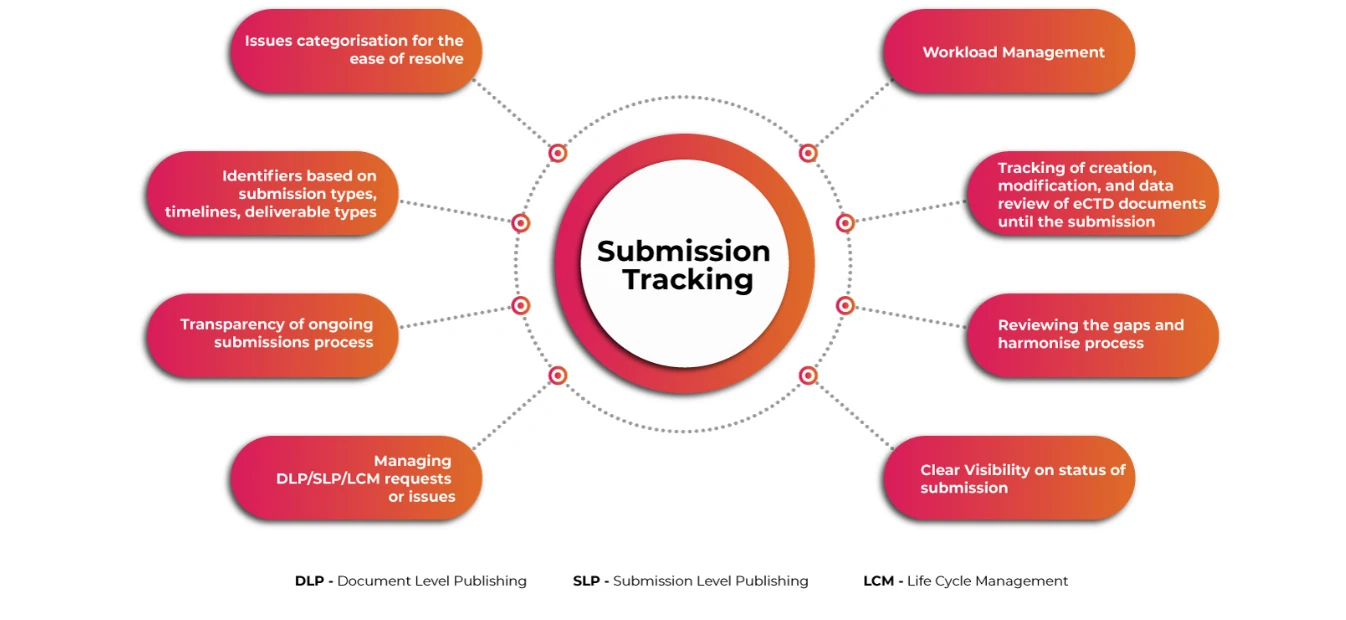
Submissions Tracker pour un aperçu complet des soumissions eCTD
Un système automatisé convivial pour la planification et le suivi des activités complexes de soumission eCTD au niveau mondial, la gestion du flux d'activités, le stockage et la gestion des applications réglementaires et des informations relatives aux soumissions est indispensable pour garantir que les demandeurs relèvent les défis associés bien avant la date prévue. La visibilité des opérations de soumission et de publication à un niveau granulaire rend l'ensemble du processus de soumission plus fluide et plus rapide.
Suivi des soumissions
La dernière mise à jour de l'eCTD
Le passage à l'eCTD 4.0 annonce une efficacité accrue et une normalisation mondiale du processus d'autorisation des médicaments pharmaceutiques. En se préparant à cette transition, votre entreprise pourra naviguer sans heurts dans ce changement et tirer parti des nombreuses opportunités era cette nouvelle era . Si le passage à l'eCTD 4.0 peut poser des défis, ceux-ci peuvent être surmontés grâce à l'engagement et à la détermination de tous les pays concernés. Bien que des investissements et des efforts importants soient nécessaires, les avantages substantiels de l'eCTD 4.0 rendent cette entreprise vraiment intéressante.
Révision du processus de soumission : l'eCTD 4.0 promet de révolutionner la manière dont les entreprises pharmaceutiques soumettent aux autorités sanitaires les données relatives au développement des médicaments. Il vise à rationaliser le processus de soumission.
Calendrier de mise en œuvre : La FDA d'accepter les nouvelles demandes au format eCTD 4.0 à partir de 2024. Les phases futures porteront sur les demandes existantes au format v3.2.2 et la communication bidirectionnelle.
Compatibilité ascendante : l'eCTD 4.0 inclut une compatibilité ascendante, permettant la réutilisation du cycle de vie et des documents du contenu de la v3.2.2. Cela simplifie la conversion des applications v3.2.2 à l'eCTD 4.0.
Critères de validation : Les spécifications des critères de validation de l'eCTD 4.0 sont disponibles. Ces critères garantissent la qualité et l'exactitude des soumissions.
Conformité mondiale : D'ici 2026, les organismes de réglementation du monde entier pourraient exiger la conformité aux normes eCTD 4.0. Bien qu'elle soit actuellement volontaire, la mise en application commencera entre 2026 et 2029.
L'avenir de l'eCTD :
Vous devez accueillir favorablement l'IA et dynamiser votre fonction réglementaire, car elle apporte une valeur ajoutée à votre entreprise. Freya Fusion est une plateforme de gestion des informations réglementaires (RIM) de pointe, basée sur l'IA et native du cloud, qui offre des performances, une sécurité et une évolutivité exceptionnelles, tout en respectant strictement les normes GxP. Enrichie de fonctionnalités avancéesML d'automatisation, Freya Fusion dans le domaine numérique, offrant des fonctionnalités supérieures et une expérience utilisateur exceptionnelle. Les avancées en matière d'IA de Freyr promettent des modules de production et de suivi des soumissions, comprenant des fonctionnalités pour la compilation, la publication et la validation transparentes des soumissions réglementaires, garantissant une conformité méticuleuse avec les directives eCTD. Rester à la pointe de la conformité réglementaire grâce à un SaaS alimenté par l'IA ne manquera pas de profiter à votre entreprise. Qu'il s'agisse d'un système d'alerte précoce pour les changements réglementaires, d'une révision et d'une analyse rationalisées des documents réglementaires ou d'analyses prédictives pour la gestion des risques, Freyr vous couvre. Reach hello@freyrdigital.compour découvrir nos innovationsML qui rationalisent les opérations réglementaires dans le secteur médical.
Gardez une longueur d'avance grâce à des mises à jour régulières et des avancées technologiques. Collaborez avec us rationaliser vos opérations réglementaires, stimuler votre productivité et améliorer la qualité de vos soumissions. Demandez une démonstration dès aujourd'hui et découvrez la combinaison parfaite entre expertise et outils. Faites passer votre organisation de bonne à excellente. us dès aujourd'hui.









