
L'IA est le nouveau mot à la mode, et son engouement ne semble pas près de s'essouffler. Nous savons tous que l'intelligence artificielle (IA) et Machine Learning ML) ont été une force de transformation dans divers secteurs, et le secteur médical ne fait pas exception. Ces dernières années,ML fait des progrès significatifs en révolutionnant les opérations réglementaires dans l'industrie médicale. Les autorités réglementaires du monde entier exploitent le potentiel deML rationaliser les processus, améliorer la prise de décision et améliorer la qualité globale des soins de santé. Voyons commentML sur le point de changer les opérations réglementaires dans le domaine médical et quelles sont les directives des autorités réglementaires concernant cette avancée technologique.
Le rôle deML les opérations réglementaires
L'intelligence artificielle offre une solution prometteuse aux défis réglementaires. Voici commentML sur le point de transformer les opérations réglementaires dans le secteur médical :
- Prise de décision éclairée grâce à l'analyse des données et à la modélisation prédictive. Les algorithmes d'IA peuvent traiter rapidement de vastes ensembles de données, ce qui permet aux autorités réglementaires d'identifier plus efficacement les tendances, les risques potentiels et les anomalies. La modélisation prédictive peut aider à évaluer la sécurité et l'efficacité des médicaments avec une plus grande précision en évitant les erreurs manuelles.
- L'automatisation des tâches de routine permet aux autorités réglementaires de se concentrer sur des tâches plus stratégiques. L'automatisation alimentée par l'IA peut rationaliser les tâches réglementaires de routine telles que la saisie de données, l'examen de documents et le contrôle de la conformité, réduisant ainsi le risque d'erreurs et accélérant les processus.
- Une surveillance améliorée de la conformité garantit que les autorités réglementaires sont à jour. L'IA peut contrôler en permanence la conformité des données avec les réglementations et les normes, en signalant les écarts ou les problèmes potentiels en temps réel, et en réduisant le risque de rappels de produits ou d'infractions à la réglementation.
- La découverte et le développement de médicaments permettent aux autorités réglementaires de mettre plus rapidement sur le marché des médicaments vitaux, tout en adoptant une approche plus économique. La découverte de médicaments basée sur l'IA peut accélérer considérablement le processus de développement, ce qui peut se traduire par des autorisations plus rapides et une réduction des coûts de développement. ML peuvent analyser des données biologiques, identifier des candidats potentiels pour de nouveaux médicaments et prédire leur efficacité, ce qui réduit considérablement le temps et les coûts associés à la mise sur le marché de nouveaux médicaments.
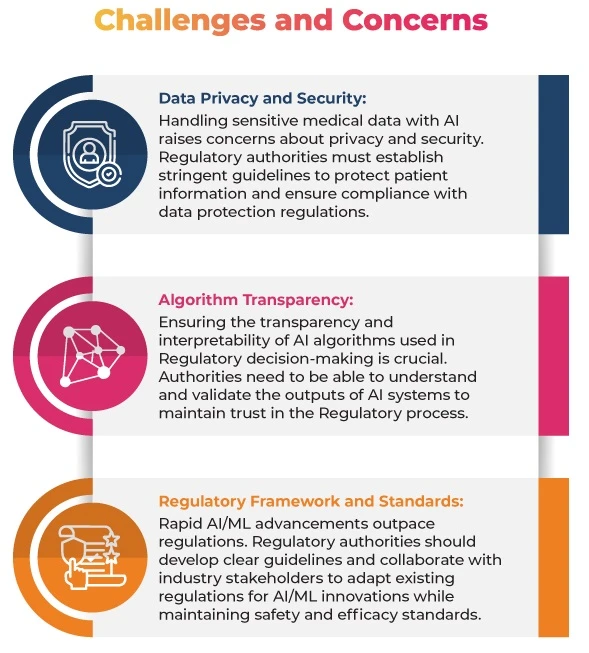
Lignes directrices des autorités réglementaires
Pour répondre à ces préoccupations, les autorités réglementaires ont déjà publié des lignes directrices et des cadres pour l'utilisationML le domaine médical :
FDA: Lignes directrices surML les dispositifs médicaux: La FDA des lignes directrices qui décrivent le cadre réglementaire applicable Software as a Medical Device ML l'IA et ML Software as a Medical Device SaMD). Ces lignes directrices fournissent des recommandations pour le développement, l'évaluation et la validation des SaMD, notamment l'utilisation de la surveillance des performances en conditions réelles, des protocoles de modification des algorithmes et des pratiques de système qualité. L'objectif est de garantir la sécurité et l'efficacité des dispositifs médicauxML tout en encourageant l'innovation et le développement dans ce domaine critique.
EMA: Utilisation de l'intelligence artificielle (IA) dans le cycle de vie des médicaments: ce document de réflexion traite de l'utilisation deML l'ensemble du cycle de vie Produits médicaux, en mettant l'accent sur la sécurité et l'efficacité. Il vise à fournir des orientations réglementaires dans leML en rapide évolutionML , en se concentrant sur les principes scientifiques nécessaires à l'évaluation de ces technologies dans les phases de développement, d'autorisation et de post-autorisation des médicaments.
MHRA: Lignes directrices sur les logiciels et l'IA en tant que dispositifs médicaux: L'Agence britannique de réglementation des médicaments et des produits de santé (MHRA) a publié des lignes directrices surML les logiciels médicaux. Elles décrivent les attentes réglementaires pour SaMDML, en soulignant l'importance de la qualité des données et de la gestion des risques.
L'arrivée deML le secteur médical transforme les opérations réglementaires, les rendant plus efficaces, axées sur les données et adaptatives. Elle a le potentiel de rationaliser les processus, de réduire les coûts de conformité, d'accélérer le développement de médicaments et, en fin de compte, d'améliorer les résultats en matière de santé publique. Cependant, cette transformation doit être mise en œuvre avec prudence, en mettant l'accent sur la validation, l'éthique et la collaboration afin de gagner la confiance des autorités réglementaires. À mesure queML d'évoluer, il sera fascinant d'observer la transformation en cours des opérations réglementaires pharmaceutiques et son impact positif sur la sécurité des patients et l'innovation dans ce domaine.
Reach hello@freyrdigital.com pour découvrir nos innovationsML qui rationalisent les opérations réglementaires dans le secteur médical. us dès aujourd'hui.









