
Medical Device Single Audit Program MDSAP) permet à un organisme d'audit reconnu (AO) de réaliser un audit unique du Quality Management System (QMS) d'un fabricant de dispositifs médicaux. Il fournit les exigences réglementaires pertinentes pour cinq pays, à savoir le Brésil (ANVISA), les États-Unis (FDA), le Japon (PMDA), le Canada (Health Canada) et l'Australie (TGA). Outre les autorités réglementaires participantes, plusieurs autres partenaires internationaux (les observateurs officiels et les membres affiliés) sont impliqués dans le MDSAP.
MDSAP est obligatoire Health Canada les dispositifs de classe II, III et IV selon Health Canada , mais elle est volontaire pour les quatre autres pays. Elle a favorisé la transparence et l'harmonisation réglementaire entre les autorités participantes et a réduit au minimum la nécessité de multiples audits, permettant ainsi aux fabricants de dispositifs médicaux d'économiser du temps et des ressources. Afin de vous donner une meilleure idée du MDSAP , nous avons tenté ici de répondre aux quinze (15) questions les plus fréquemment posées.
- Pourquoi MDSAP a-t-il été a-t-il été développé alors qu'il existe déjà une ISO 13485 reconnue à l'échelle mondiale ?
MDSAP développé afin de réduire la charge des audits réglementaires pour les fabricants de dispositifs médicaux et de promouvoir une plus grande harmonisation des approches réglementaires et des exigences techniques sur la base des normes internationales et des meilleures pratiques. Il vise à apporter cohérence, prévisibilité et transparence aux programmes réglementaires en normalisant les procédures et les pratiques des organismes de réglementation et des organismes d'audit tiers.
L'audit est basé sur les exigences du système de gestion de la qualité (QMS) selon ISO 13485 les exigences réglementaires du pays participant où les dispositifs médicaux seront commercialisés.
- Quels sont les critères d'éligibilité pour se soumettre à un MDSAP ?
Tout fabricant de dispositifs médicaux souhaitant commercialiser ses produits dans les pays participants peut se soumettre à un MDSAP . Toutefois, chaque autorité réglementaire peut établir des critères d'exclusion pour certaines conditions si nécessaire.
Par exemple, au Japon, les exceptions à l'éligibilité sont les suivantes :
- Un site de fabrication agréé (SFA) qui fabrique des dispositifs médicaux à partir de tissus humains/animaux.
- Un SMR qui fabrique des DIV radioactifs, et
- Création d'un titulaire d'autorisation de mise sur le marché (MAH)
- MDSAP inclut-il les produits combinés ?
Les dispositifs médicaux qui contiennent des médicaments (substances médicamenteuses) ou des produits biologiques (par exemple, des matières d'origine animale rendues non viables, des tissus, des cellules ou des substances d'origine microbienne ou recombinante, du sang humain ou des extraits de sang humain ou des produits sanguins, etc.) sont considérés comme des produits combinés et peuvent être inclus dans le champ d'application d'un MDSAP .
Toutefois, en raison des différences dans la manière dont ces produits sont réglementés dans les juridictions des autorités réglementaires participantes, les rapports MDSAP et les documents de certification peuvent ne pas être considérés comme une alternative aux exigences d'inspection et d'évaluation dans certaines juridictions.
Australie - Les produits combinés sont soumis à un examen hors site de la TGA dans le cadre de l'évaluation de conformité australienne. Cependant, un MDSAP efficace peut réduire les inspections pour ces dispositifs.
Brésil, Japon - Les produits combinés considérés comme des dispositifs médicaux sont inclus dans MDSAP, car il n'existe aucune exigence spécifique concernant le SMQ.
Canada - MDSAP couvre les exigences du SMQ pour les produits combinés considérés comme des dispositifs médicaux.
États-Unis - MDSAP ne sont pas considérés comme des alternatives aux FDA pour les produits combinés.
- Puis-je sélectionner le pays concerné par MDSAP ?
Oui, l'audit est réalisé conformément au champ d'application déclaré dans la demande de services de certification. Les fabricants de dispositifs médicaux sont censés se conformer aux réglementations uniquement dans les juridictions où leurs produits doivent être commercialisés.
- Je suis un fabricant US de dispositifs médicaux et j'ai l'intention de commercialiser mon dispositif uniquement au Japon. Je vais bientôt subir un MDSAP . Dois-je également me conformer aux exigences d'autres pays ?
Non, les fabricants de dispositifs médicaux sont uniquement tenus de se conformer aux ISO 13485 et réglementations de ISO 13485 dans les juridictions où leurs produits sont commercialisés.
- Mon organisme d'audit (OA) et mon organisme notifié européen sont les mêmes. Puis-je être audité pour les deux en même temps ?
Si votre AO et votre organisme notifié européen sont identiques, l'évaluation de la conformité peut être effectuée après la réalisation de MDSAP , et non simultanément. Les organismes notifiés européens sont des observateurs pour MDSAP, et l'évaluation de la conformité est effectuée conformément au règlement EU MDR . Pour MDSAP, l'évaluation est effectuée conformément aux exigences de ISO 13485 aux exigences réglementaires des pays participants concernés.
- Quelle est la différence entre les évaluations des phases I et II ?
Le processus d'audit MDSAP comprend deux étapes. L'audit initial, également appelé audit de certification initiale, comprend les audits de phase I et de phase II.
L'audit de phase I comprend l'examen de la documentation et l'évaluation de l'état de préparation du fabricant de dispositifs médicaux en vue d'un audit de phase II.
L'audit de phase II est réalisé afin de vérifier si toutes les exigences applicables de ISO 13485 les autres exigences réglementaires de l'autorité réglementaire concernée sont mises en œuvre.
- Combien d'auditeurs puis-je attendre pour un MDSAP ?
La détermination de la durée de l'audit spécifie comment déterminer la durée de l'audit sur site en jours-homme. L'AO décide du nombre d'auditeurs qui composeront l'équipe d'audit. Par exemple, un audit de six (06) jours-homme peut être réalisé en trois (03) jours par une équipe de deux (02) auditeurs.
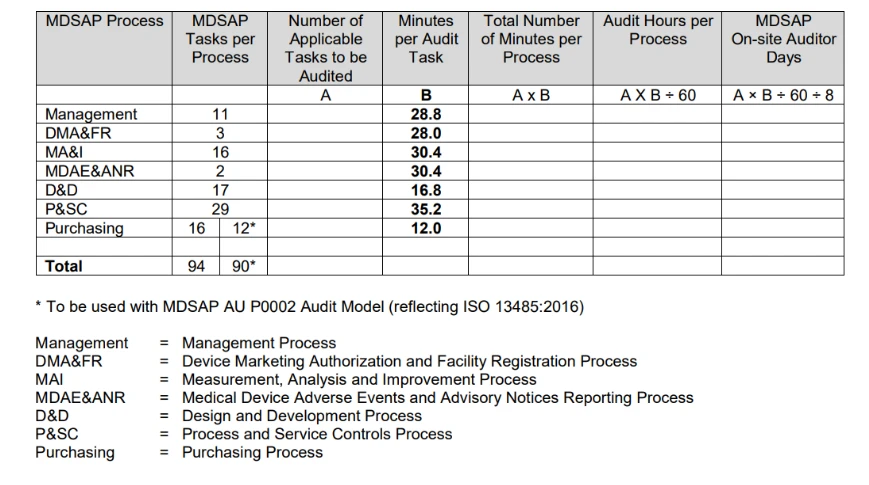
- Comment MDSAP est-il planifié dans le temps ?
La procédure de détermination de la durée d'un audit, publiée par la FDA, résume le processus de calcul de la durée d'un audit dans le tableau suivant.
Le calcul de la durée de l'audit est principalement basé sur le nombre de tâches d'audit applicables associées au type d'audit à réaliser et aux activités spécifiques de l'organisation à auditer.
Pour plus d'informations à ce sujet, vous pouvez vous référer au MDSAP .
- Existe-t-il un guide ou une liste de contrôle auquel je peux avoir accès pour m'assurer de la conformité à un MDSAP ?
Oui, vous pouvez accéder au document « MDSAP Approach » (Approche d'audit MDSAP). Il s'agit d'un guide bien organisé publié par la USFDA renvoie à des sections spécifiques de ISO 13485:2016 et aux réglementations pertinentes publiées par la TGA australienne, ANVISA brésilienne, Health Canada,PMDA japonais et laFDA US .
- Quel est le rôle d'un observateur dans un MDSAP ?
Un MDSAP est une autorité réglementaire autorisée à assister aux réunions, aux évaluations et à d'autres activités, mais qui n'utilise pas les MDSAP . Les observateurs sont représentés au sein du Conseil des autorités MDSAP (RAC) par un cadre supérieur.
- Quelles sont les prochaines étapes à suivre si j'ai reçu une note de 4 ou plus ?
Le système de notation est attribué aux non-conformités observées lors de l'audit par l'OA. Une note de 4 ou 5 indique un risque élevé d'intervention. Vous devez fournir un plan d'assainissement pour chaque non-conformité enregistrée dans un délai de 15 jours calendaires à compter de la date d'émission du rapport de non-conformité. Le plan d'assainissement doit inclure les résultats de l'enquête sur la non-conformité, ses causes et les actions correctives prévues pour éviter qu'elle ne se reproduise. La preuve de la mise en œuvre du plan/de l'action de remédiation doit être fournie dans les trente (30) jours calendaires suivant la date de fin de l'audit.
- Existe-t-il une différence dans le processus d'approche de l'audit entre un auditeur interne et un OA ?
MDSAP une approche processus. L'AO est susceptible d'examiner les liens et les fils conducteurs, tandis qu'un auditeur interne pourrait se concentrer davantage sur un aspect fonctionnel à la fois. Par conséquent, l'AO pourrait constater une non-conformité dans un domaine fonctionnel et chercher des réponses dans un autre domaine fonctionnel. Cependant, suivre l'approche processus pourrait perturber le déroulement d'un audit interne.
- Puis-je faire appel à l'AO si je peux prouver qu'une non-conformité enregistrée n'est pas valable ?
L'AO dispose d'une procédure d'appel ou de contestation, que vous pouvez utiliser si vous pouvez démontrer qu'une non-conformité enregistrée n'est pas valable. Toutefois, les notes attribuées aux non-conformités ne peuvent pas être modifiées à la suite d'actions correctives. Elles ne peuvent être modifiées que sur la base de preuves démontrant qu'elles n'étaient pas valables.
- Quelle est la durée de validité du MDSAP ?
Les fabricants de dispositifs médicaux certifiés dans le cadre MDSAP seront audités chaque année, selon un cycle de certification de trois ans. L'audit initial consiste en un audit complet du système de gestion de la qualité (SGQ) du fabricant de dispositifs médicaux. Il est suivi d'audits de surveillance effectués chaque année pendant deux (02) années consécutives. Le cycle recommence avec un audit de recertification la troisième année.
Pour en savoir plus sur nos MDSAP , contactez Freyr dès aujourd'hui afin d'organiser un entretien téléphonique avec nos experts.









