
Dans le monde dynamique des produits pharmaceutiques, le rôle des données concrètes (RWD) et des preuves concrètes (RWE) devient de plus en plus central. Ces outils font le lien entre l'environnement contrôlé des essais cliniques et les complexités réelles des soins prodigués aux patients. Plusieurs sociétés pharmaceutiques ont utilisé avec succès les RWD/RWE pour appuyer leurs demandes d'autorisation réglementaire. Par exemple, en 2022, Bristol Myers Squibb a obtenu FDA pour l'utilisation d'Opdivo (nivolumab) en association avec Yervoy (ipilimumab) dans le traitement de première intention du mélanome métastatique, sur la base des données RWE issues de l'essai CheckMate 151.
Avec la récente FDA lignes directrices FDA en octobre 2023 qui ouvre la voie, il est temps pour les innovateurs pharmaceutiques d'exploiter le potentiel des données réelles (RWD) et des données réelles (RWE) pour les demandes d'autorisation réglementaire.
RWD/RWE peut être utilisé pour soutenir une variété de soumissions réglementaires, y compris :
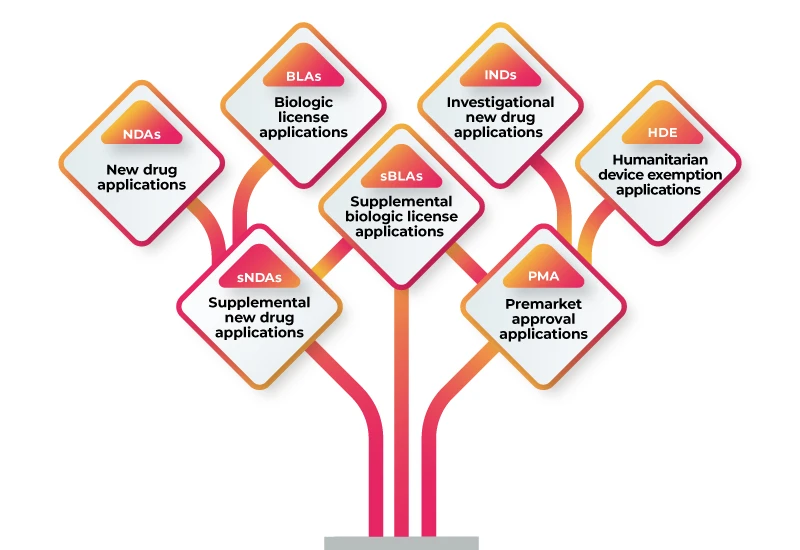
Pour utiliser RWD/RWE à l'appui de votre demande d'autorisation, vous devez suivre les étapes suivantes :
Étape 1 : Définir votre question réglementaire
Commencez par identifier la principale question réglementaire à laquelle vous souhaitez répondre. Qu'il s'agisse de la sécurité, de l'efficacité ou de la performance dans des scénarios réels, il est essentiel que votre objectif soit clair.
Étape 2 : Sélectionner des sources RWD de qualité
La qualité est la clé. Choisissez des sources de RWD qui sont en corrélation directe avec votre question réglementaire. Les dossiers médicaux électroniques, les données relatives aux demandes de remboursement et les registres de patients sont des ressources inestimables.
Étape 3 : Élaborer un plan d'étude solide
La conception de votre étude doit refléter votre question réglementaire et respecter les directives réglementaires. Votre approche doit être conforme aux attentes FDA.
Étape 4 : Analyser et générer des ERF
Utilisez des méthodes statistiques solides pour votre analyse. Une documentation claire est essentielle pour garantir la transparence et la crédibilité.
Étape 5 : Interpréter et présenter vos résultats
L'objectivité est la pierre angulaire de l'interprétation de RWE. Votre présentation doit être adaptée à votre public et transmettre avec précision l'ensemble des éléments de preuve.
Voici quelques conseils pour utiliser le RWD/RWE afin d'étayer votre demande d'autorisation :
- Compléter, ne pas remplacer les essais cliniques : La RWD/RWE renforce les preuves de sécurité et d'efficacité, mais ne remplace pas les essais cliniques bien conçus.
- Limites transparentes : Reconnaître la nature observationnelle de la RWD/RWE, les biais potentiels et les facteurs de confusion non contrôlés.
- Collaborer avec les organismes de réglementation : Travaillez en étroite collaboration avec les organismes de réglementation afin d'aligner votre utilisation de RWD/RWE sur leurs attentes.
En suivant ces étapes et ces conseils, vous pouvez utiliser le RWD/RWE pour soutenir votre demande d'autorisation et mettre votre produit sur le marché plus rapidement et plus efficacement.
En vous lançant dans cette aventure RWD et RWE, n'oubliez pas que vous ouvrez la voie à des soumissions réglementaires plus efficaces et mieux informées. L'avenir de l'innovation pharmaceutique repose sur les données du monde réel. Adoptez-les, exploitez-les et marquez l'industrie de votre empreinte.
Prêt à rationaliser votre processus de soumission réglementaire ? Découvrez notre logiciel de soumission réglementaire à la pointe de la technologie Freyr PRO dès aujourd'hui !









