Pisanie tekstów regulacyjnych odgrywa kluczową rolę w branży farmaceutycznej i opieki zdrowotnej, łącząc złożone informacje naukowe z różnymi interesariuszami. Sztuka dostosowywania tekstów regulacyjnych do różnych odbiorców ma zasadnicze znaczenie dla skutecznej komunikacji i zgodności z przepisami. Na tym blogu dowiemy się, jak dostosować teksty regulacyjne dla trzech (3) kluczowych grup odbiorców: pacjentów, klinicystów i organów regulacyjnych.
Zrozumienie znaczenia pisania dostosowanego do odbiorców
Pisma regulacyjne obejmują różne dokumenty, z których każdy służy określonemu celowi i jest skierowany do różnych czytelników. Zdolność do dostosowania treści do tych różnych odbiorców ma kluczowe znaczenie dla zapewnienia, że informacje są dokładne, ale także dostępne i wykonalne.
Podstawowe wskazówki dotyczące podejścia opartego na dostosowaniu:
Pisanie dla pacjentów: Upraszczanie złożonych informacji
Podczas tworzenia dokumentów regulacyjnych dla pacjentów, głównym celem jest przekazanie istotnych informacji w sposób jasny i zrozumiały bez poświęcania dokładności.
- Używanie prostego języka
Używaj codziennych słów i unikaj technicznego żargonu. Jeśli konieczne jest użycie terminów medycznych, należy je jasno wyjaśnić.
- Pomoce wizualne i formatowanie
Dołączaj diagramy, wykresy i infografiki, aby zilustrować złożone koncepcje. Używaj wypunktowań, nagłówków i krótkich akapitów, aby zwiększyć czytelność.
- Rozwiązywanie typowych problemów
Przewidywanie i odpowiadanie na potencjalne pytania lub wątpliwości pacjentów dotyczące leków lub leczenia.
Przykład: Ulotki informacyjne dla pacjentów
Dokumenty te powinny:

Pisanie dla lekarzy: Równoważenie szczegółowości i praktyczności
Lekarze potrzebują kompleksowych, ale zwięzłych informacji, aby podejmować świadome decyzje dotyczące opieki nad pacjentem. Pisma regulacyjne dla tej grupy odbiorców muszą równoważyć szczegóły naukowe i praktyczne zastosowanie.
- Nacisk na znaczenie kliniczne
Skoncentruj się na informacjach mających wpływ na opiekę nad pacjentem, takich jak wytyczne dotyczące dawkowania, przeciwwskazania i interakcje leków.
- Ustrukturyzowana prezentacja danych
Organizowanie wyników badań klinicznych i danych dotyczących bezpieczeństwa w logicznym, łatwym do nawigacji formacie. Użyj tabel i wykresów, aby podsumować kluczowe ustalenia.
- Włączenie zaleceń opartych na dowodach
Zapewnienie jasnych, opartych na dowodach wytycznych dotyczących właściwego stosowania leków lub urządzeń medycznych w różnych scenariuszach klinicznych.
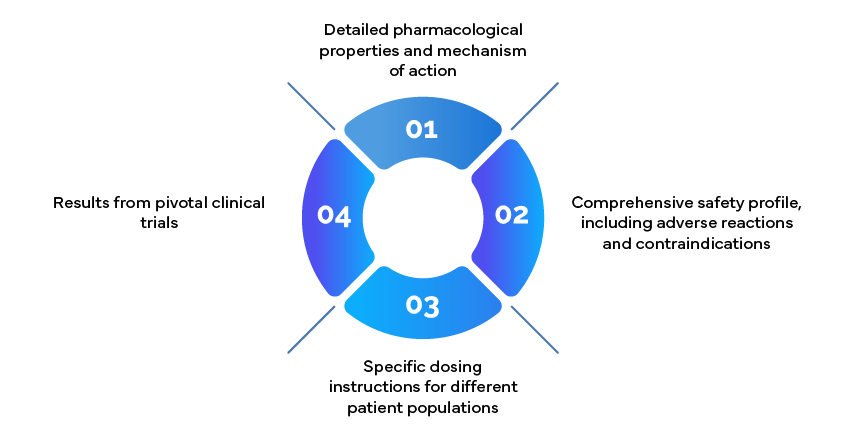
Przykład: Informacje o przepisywaniu leków
Dokumenty zawierające informacje o przepisywaniu leków, znane również jako ulotki dołączane do opakowań, są kluczowymi zasobami dla lekarzy. Powinny one zawierać:
Pisanie dla organów regulacyjnych: Precyzja i zgodność
Agencje regulacyjne wymagają wyczerpującej, naukowo rygorystycznej dokumentacji w celu oceny bezpieczeństwa i skuteczności nowych produktów. Pisanie dla tej grupy odbiorców wymaga skrupulatnej dbałości o szczegóły i ścisłego przestrzegania wytycznych regulacyjnych.
- Przestrzeganie wytycznych regulacyjnych
Upewnij się, że wszystkie dokumenty są zgodne z konkretnymi wymaganiami dotyczącymi formatu i treści organów regulacyjnych, takich jak FDA EMA.
- Kompleksowa prezentacja danych
Zapewnienie dokładnej analizy wszystkich istotnych danych, w tym szczegółowych opisów metodologii badań, analiz statystycznych i interpretacji wyników.
- Przejrzystość w raportowaniu
Ujawnij wszelkie ograniczenia lub potencjalne uprzedzenia w badaniach i odnieś się do tego, w jaki sposób czynniki te mogą wpływać na wnioski.
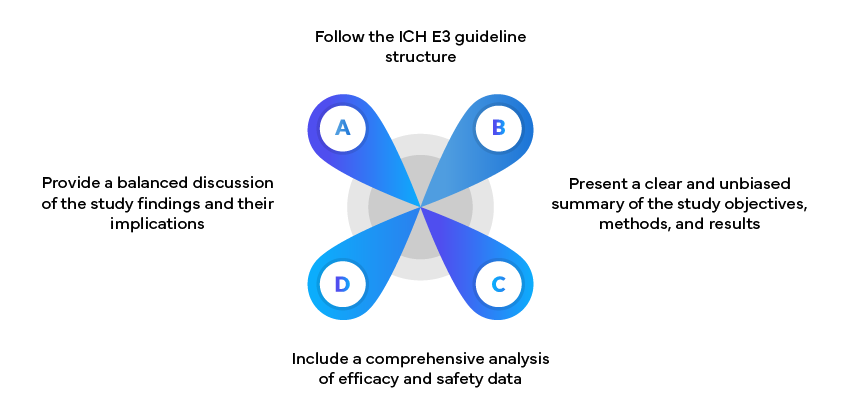
Przykład: Raporty z badań klinicznych
Raporty z badań klinicznych (CSR) są kluczowymi dokumentami w zgłoszeniach do organów regulacyjnych. Powinny one:
Wnioski
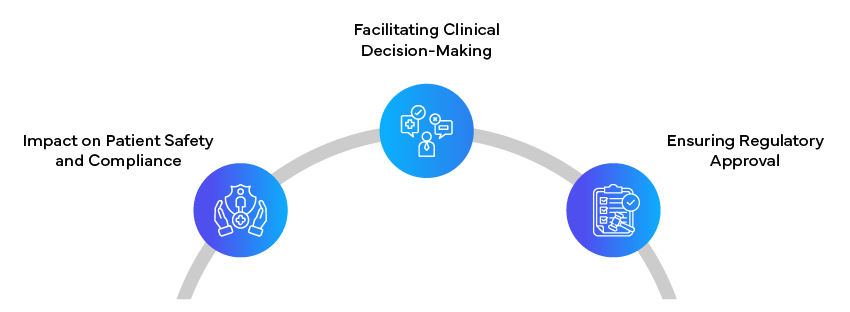
Dostosowanie tekstów regulacyjnych dla różnych odbiorców jest złożonym, ale niezbędnym zadaniem w branży farmaceutycznej i opieki zdrowotnej. Dostosowując treści i style prezentacji do konkretnych potrzeb pacjentów, klinicystów i organów regulacyjnych, autorzy mogą zapewnić, że krytyczne informacje są skutecznie przekazywane i rozumiane.
Zdolność do tworzenia jasnych, dokładnych i dostosowanych do odbiorców dokumentów regulacyjnych to nie tylko kwestia zgodności; ma ona bezpośredni wpływ na bezpieczeństwo pacjentów, podejmowanie decyzji klinicznych oraz udany rozwój i marketing nowych produktów opieki zdrowotnej. Wraz z ciągłą ewolucją otoczenia regulacyjnego, znaczenie umiejętnego pisania dokumentów regulacyjnych, które mogą wypełnić lukę między złożonymi danymi naukowymi a różnorodnymi potrzebami interesariuszy, będzie tylko rosło. Autorzy tekstów regulacyjnych odgrywają kluczową rolę w promowaniu zdrowia publicznego i wspieraniu innowacji w dziedzinie medycyny, koncentrując się na przejrzystości dla pacjentów, znaczeniu klinicznym dla pracowników służby zdrowia i kompleksowej precyzji dla organów regulacyjnych. Opanowanie sztuki pisania tekstów regulacyjnych dostosowanych do potrzeb odbiorców jest zatem nieocenioną umiejętnością w dzisiejszym szybko zmieniającym się środowisku opieki zdrowotnej.









