
W coraz bardziej złożonym świecie badań klinicznych, firmy farmaceutyczne i biotechnologiczne często polegają na zewnętrznych partnerach w celu przeprowadzenia badań klinicznych. Partnerstwa te zapewniają znaczące korzyści, w tym dostęp do specjalistycznej wiedzy, zaawansowanych technologii i zwiększonej wydajności operacyjnej. Aby jednak zmaksymalizować te korzyści i zapewnić powodzenie badań klinicznych, kluczowe jest utrzymanie solidnego nadzoru nad Wnioskodawcą/Sponsorem. Niniejszy blog poświęcony jest znaczeniu nadzoru nad wnioskodawcą/sponsorem w zakontraktowanych badaniach klinicznych oraz temu, w jaki sposób może on prowadzić do bardziej wiarygodnych i wpływowych wyników badań.
Rola nadzoru wnioskodawcy/sponsorów:
Nadzór nad wnioskodawcą/sponsorem odnosi się do proaktywnego zarządzania i nadzorowania zakontraktowanych badań klinicznych przez firmę sponsora.
Na czym polega nadzór nad Wnioskodawcą/Sponsorem?
Skuteczny nadzór zapewnia, że badanie jest prowadzone zgodnie z wcześniej określonymi standardami i przepisami, tym samym chroniąc bezpieczeństwo, integralność i ważność wyników badań.
Kluczowe aspekty nadzoru nad wnioskodawcą/sponsorami:
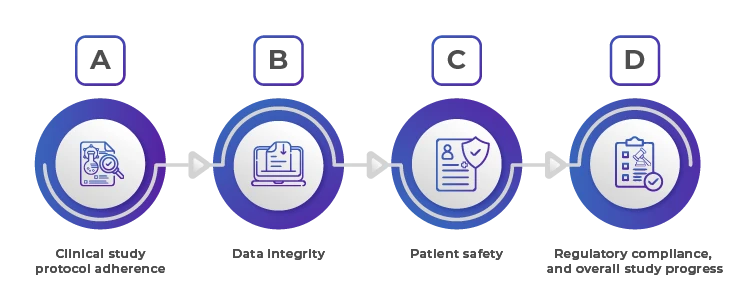
1. Przestrzeganie protokołu badania klinicznego
Zapewnienie, że zakontraktowana organizacja postępuje zgodnie z protokołem badania ma kluczowe znaczenie. Wszelkie odchylenia mogą zagrozić ważności wyników badania i prowadzić do kontroli regulacyjnej. Regularne audyty i wizyty monitorujące są niezbędne do weryfikacji przestrzegania protokołu. Sponsor musi zapewnić jasne, szczegółowe wytyczne i przeprowadzać okresowe szkolenia, aby upewnić się, że wszystkie zainteresowane strony rozumieją i przestrzegają protokołu.
- Szczegółowe szkolenie w zakresie protokołu: Zapewnienie kompleksowego szkolenia w zakresie protokołu badania dla całego personelu zaangażowanego w badanie kliniczne gwarantuje, że wszyscy rozumieją cele, procedury i oczekiwane wyniki badania. Obejmuje to tworzenie szczegółowych podręczników szkoleniowych i przeprowadzanie regularnych sesji odświeżających.
- Ścieżki audytu: Ustanowienie ścieżek audytu pomaga śledzić każdą zmianę wprowadzoną do protokołu badania i danych. Dokumentacja ta ma kluczowe znaczenie dla zachowania przejrzystości i odpowiedzialności, umożliwiając identyfikację wszelkich odchyleń od protokołu.
2. Integralność danych
Dokładne i wiarygodne dane są podstawą każdego badania klinicznego. Mechanizmy nadzoru powinny obejmować regularne przeglądy danych, weryfikację danych źródłowych i audyty w celu zapewnienia, że dane są gromadzone, rejestrowane i raportowane dokładnie. Wiąże się to również z zapewnieniem, że elektroniczne systemy gromadzenia danych są zweryfikowane i bezpieczne. Wdrożenie solidnych praktyk zarządzania danymi i wykorzystanie zaawansowanej analizy danych może pomóc we wczesnym wykrywaniu rozbieżności i anomalii.
- Systemy zarządzania danymi: Wykorzystanie zaawansowanych systemów zarządzania danymi, które obsługują gromadzenie, weryfikację i analizę danych w czasie rzeczywistym, zapewnia integralność i dokładność danych klinicznych. Systemy te powinny być zgodne z normami regulacyjnymi, takimi jak 21 CFR Part 11.
- Kontrole jakości danych: Regularne kontrole jakości i procesy czyszczenia danych pomagają zidentyfikować i naprawić wszelkie niespójności lub błędy w danych, zapewniając, że ostateczny zestaw danych jest wiarygodny i gotowy do analizy.
3. Bezpieczeństwo pacjentów
Bezpieczeństwo uczestników badania jest najważniejsze. Sponsorzy muszą upewnić się, że zakontraktowana organizacja posiada solidne systemy monitorowania zdarzeń niepożądanych i szybkiego wdrażania działań naprawczych. Obejmuje to regularne przeglądy bezpieczeństwa i zapewnienie zgodności z wytycznymi Dobrej Praktyki Klinicznej (GCP). Regularne audyty bezpieczeństwa, mechanizmy informacji zwrotnej od pacjentów i narzędzia monitorowania w czasie rzeczywistym mają zasadnicze znaczenie dla ochrony dobrostanu pacjentów.
- Systemy zgłaszania zdarzeń niepożądanych: Wdrożenie skutecznych systemów zgłaszania zdarzeń niepożądanych zapewnia, że potencjalne kwestie bezpieczeństwa są szybko identyfikowane i rozwiązywane. Systemy te powinny umożliwiać natychmiastowe zgłaszanie i śledzenie zdarzeń niepożądanych.
- Technologie monitorowania pacjentów: Zaawansowane technologie monitorowania pacjentów, takie jak urządzenia do noszenia na ciele, mogą dostarczać ciągłych danych zdrowotnych, umożliwiając szybką interwencję i zapewniając bezpieczeństwo pacjentów podczas całego badania.
4. Zgodność z przepisami
Badania kliniczne muszą być zgodne z lokalnymi i międzynarodowymi wymogami regulacyjnymi. Skuteczny nadzór obejmuje zapewnienie, że zakontraktowana organizacja przestrzega tych przepisów oraz że wszystkie niezbędne zatwierdzenia i dokumentacja są na miejscu. Obejmuje to zrozumienie krajobrazu regulacyjnego każdego regionu, w którym prowadzone jest badanie, oraz zapewnienie, że cała dokumentacja jest aktualizowana i łatwo dostępna do przeglądów regulacyjnych.
- Szkolenie w zakresie przepisów: Zapewnienie ciągłego szkolenia w zakresie wymogów regulacyjnych dla całego personelu badawczego gwarantuje, że są oni świadomi i przestrzegają wszystkich odpowiednich przepisów i wytycznych.
- Zarządzanie dokumentacją regulacyjną: Wdrożenie solidnych systemów zarządzania dokumentacją regulacyjną zapewnia, że wszystkie wymagane zatwierdzenia, raporty i rejestry są przechowywane dokładnie i są łatwo dostępne dla audytów i inspekcji.
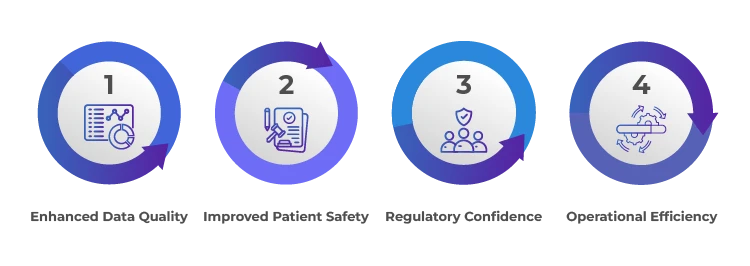
Korzyści ze skutecznego nadzoru nad kandydatami/sponsorami
Podsumowanie
Nadzór wnioskodawcy/sponsora nad badaniami klinicznymi realizowanymi na podstawie umowy jest nie tylko wymogiem regulacyjnym, ale także strategiczną koniecznością. Zapewnia on integralność, bezpieczeństwo i wiarygodność badań klinicznych, co ostatecznie prowadzi do uzyskania bardziej rzetelnych i wiarygodnych wyników badań. Doświadczenie partnera regulacyjnego w zakresie usług regulacyjnych oraz kompleksowe możliwości nadzoru mogą pomóc w poruszaniu się po zawiłościach badań klinicznych, zapewniając prowadzenie badań zgodnie z najwyższymi standardami. Nawiąż współpracę z Freyr usprawnić nadzór nad badaniami klinicznymi i osiągnąć cele badawcze z pewnością siebie.









