
Medical Device Single Audit Program MDSAP) umożliwia uznanej organizacji audytowej (AO) przeprowadzenie jednej kontroli Quality Management System (QMS) producenta wyrobów medycznych. Zawiera on odpowiednie wymogi regulacyjne dla pięciu krajów, tj. Brazylii (ANVISA), USA (FDA), Japonii (PMDA), Kanady (Health Canada) i Australii (TGA). Oprócz uczestniczących organów regulacyjnych w programie MDSAP bierze udział kilku innych międzynarodowych partnerów (oficjalni obserwatorzy i członkowie stowarzyszeni).
MDSAP jest wymagana przez Health Canada urządzeń klasy II, III i IV, ale jest dobrowolna dla pozostałych czterech krajów. Promuje ona przejrzystość i ujednolicenie przepisów między uczestniczącymi organami oraz minimalizuje potrzebę przeprowadzania wielu audytów, oszczędzając w ten sposób czas i zasoby producentów urządzeń medycznych. Aby lepiej przedstawić MDSAP , postaraliśmy się odpowiedzieć na piętnaście (15) najczęściej zadawanych pytań.
- Dlaczego MDSAP ? , skoro istnieje uznana na całym świecie ISO 13485 ?
MDSAP opracowany w celu zmniejszenia obciążenia producentów wyrobów medycznych audytami regulacyjnymi oraz promowania większej spójności podejść regulacyjnych i wymagań technicznych w oparciu o międzynarodowe standardy i najlepsze praktyki. Koncentruje się on na zapewnieniu spójności, przewidywalności i przejrzystości programów regulacyjnych poprzez standaryzację procedur i praktyk organów regulacyjnych oraz zewnętrznych organizacji audytowych.
Audyt opiera się na wymaganiach systemu zarządzania jakością zgodnie z ISO 13485 wymaganiach regulacyjnych kraju uczestniczącego, w którym wyroby medyczne wprowadzane do obrotu.
- Jakie są kryteria kwalifikacyjne do poddania się MDSAP ?
Każdy producent wyrobów medycznych zamierzający wprowadzić swoje wyroby do obrotu w krajach uczestniczących w programie może poddać się MDSAP . Jednakże każdy organ regulacyjny może w razie potrzeby ustanowić kryteria wykluczenia dla określonych warunków.
Na przykład w Japonii wyjątki od kwalifikowalności są następujące:
- Zarejestrowany zakład produkcyjny (RMS) wytwarzający wyroby medyczne tkanek ludzkich/zwierzęcych
- RMS, który produkuje radioaktywne IVD, oraz
- Ustanowienie Pozwolenie na dopuszczenie do obrotu produktu leczniczego (MAH)
- Czy MDSAP obejmuje produkty złożone?
wyroby medyczne leki (substancje lecznicze) lub produkty biologiczne (np. materiały pochodzenia zwierzęcego, które zostały unieszkodliwione, lub tkanki, komórki lub substancje pochodzenia mikrobiologicznego lub rekombinowanego, krew ludzka lub ekstrakty z krwi ludzkiej lub produkty krwiopochodne itp.) są uważane za produkty złożone i mogą być objęte zakresem MDSAP .
Jednak ze względu na różnice w sposobie regulacji tych produktów w jurysdykcjach uczestniczących organów regulacyjnych, raporty MDSAP i dokumenty certyfikacyjne mogą nie być uznawane za alternatywę dla wymogów dotyczących kontroli i oceny w niektórych jurysdykcjach.
Australia — Produkty złożone podlegają kontroli poza siedzibą firmy przeprowadzanej przez TGA w ramach australijskiej oceny zgodności. Jednak skuteczny MDSAP może ograniczyć liczbę kontroli tych urządzeń.
Brazylia, Japonia – Produkty złożone uznawane za wyroby medyczne objęte MDSAP, ponieważ nie ma żadnych szczególnych wymagań dotyczących systemu zarządzania jakością.
Kanada – MDSAP obejmuje wymagania dotyczące systemu zarządzania jakością dla produktów złożonych uznawanych za wyroby medyczne.
USA — MDSAP nie są traktowane jako alternatywa dla FDA w przypadku produktów złożonych.
- Czy mogę wybrać kraj objęty MDSAP ?
Tak, audyt jest przeprowadzany zgodnie z zakresem zadeklarowanym we wniosku o świadczenie usług certyfikacyjnych. Od producentów urządzeń medycznych oczekuje się zgodności z przepisami tylko w jurysdykcjach, w których ich produkty mają być wprowadzane do obrotu.
- Jestem producentem urządzeń medycznych z US i zamierzam sprzedawać swoje urządzenia wyłącznie w Japonii. Niedługo będę miał MDSAP . Czy muszę spełniać wymagania innych krajów?
Nie, producenci urządzeń medycznych muszą jedynie spełniać ISO 13485 i przepisy obowiązujące w jurysdykcjach, w których ich produkty mają być wprowadzane do obrotu.
- Moja organizacja audytująca (AO) i europejska jednostka notyfikowana są takie same. Czy mogę zostać poddany audytowi w obu jednostkach jednocześnie?
Jeśli Państwa AO i europejska jednostka notyfikowana są takie same, ocena zgodności może zostać przeprowadzona po przeprowadzeniu MDSAP , a nie jednocześnie. Europejskie jednostki notyfikowane są obserwatorami MDSAP, a ocena zgodności jest przeprowadzana zgodnie z rozporządzeniem EU MDR . W przypadku MDSAP ocena jest przeprowadzana zgodnie z wymaganiami normy ISO 13485 wymogami regulacyjnymi krajów uczestniczących w zakresie.
- Jaka jest różnica między ocenami na etapie I i II?
Proces MDSAP audytu MDSAP składa się z dwóch etapów. Audyt wstępny, zwany również audytem certyfikacyjnym, obejmuje audyty etapu I i etapu II.
Audyt Etapu I obejmuje przegląd dokumentacji i ocenę gotowości producenta urządzenia medycznego do poddania się audytowi Etapu II.
Audyt etapu II przeprowadza się w celu sprawdzenia, czy wszystkie obowiązujące wymagania normy ISO 13485 inne wymagania regulacyjne organu regulacyjnego w zakresie zostały wdrożone.
- Ilu audytorów mogę spodziewać się podczas MDSAP ?
Określanie czasu audytu określa sposób określania czasu trwania audytu na miejscu w osobodniach. AO decyduje, ilu audytorów będzie tworzyć zespół audytowy. Na przykład audyt trwający (06) osobodni może zostać ukończony w ciągu trzech (03) dni przez zespół składający się z dwóch (02) audytorów.
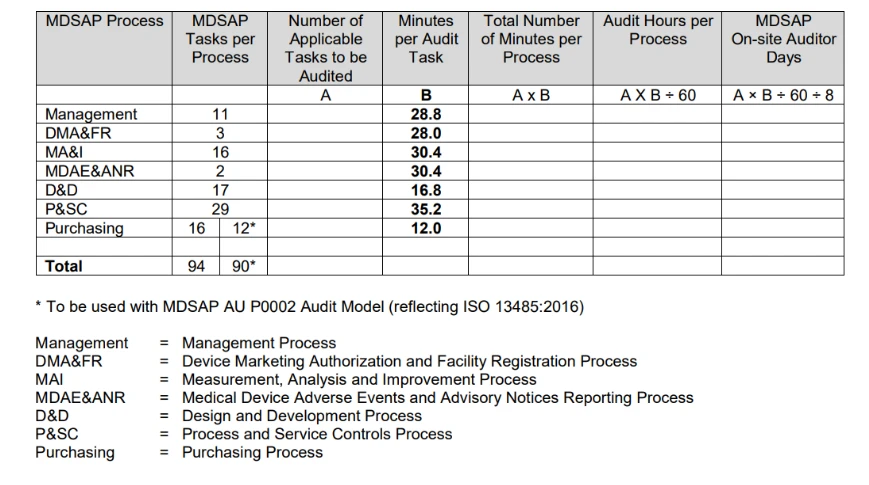
- Jak wygląda harmonogram MDSAP ?
Procedura ustalania czasu trwania audytu, wydana przez FDA, podsumowuje proces ustalania czasu trwania audytu w poniższej tabeli.
Obliczenie czasu trwania audytu opiera się przede wszystkim na liczbie odpowiednich zadań audytowych związanych z rodzajem audytu, który ma zostać przeprowadzony, oraz konkretnymi działaniami organizacji, które mają zostać poddane audytowi.
Szczegółowe informacje na ten temat można znaleźć w MDSAP .
- Czy istnieje przewodnik lub lista kontrolna, z której mogę skorzystać, aby zapewnić zgodność z MDSAP ?
Tak, można uzyskać dostęp do dokumentu dotyczącego podejściaMDSAP . Jest to dobrze zorganizowany przewodnik wydany przez USFDA odniesienia do konkretnych sekcji ISO 13485:2016 oraz odpowiednich przepisów wydanych przez australijską agencję TGA, brazylijską ANVISA, kanadyjską Health Canada, japońskąPMDA oraz US agencjęFDA.
- Jaka jest rola obserwatora podczas MDSAP ?
MDSAP to organ regulacyjny, który może uczestniczyć w posiedzeniach, ocenach i innych działaniach, ale nie korzysta z MDSAP . Obserwatorzy są reprezentowani w Radzie Organów MDSAP (RAC) przez jednego menedżera wyższego szczebla.
- Jakie kolejne kroki należy podjąć, jeśli otrzymałem ocenę 4 lub wyższą?
System oceniania jest przyznawany niezgodnościom zaobserwowanym podczas audytu przez AO. Ocena 4 lub 5 oznacza wysokie ryzyko interwencji. Dla każdej odnotowanej niezgodności należy przedstawić plan naprawczy w ciągu 15 dni kalendarzowych od daty wydania raportu o niezgodności. Plan naprawczy musi zawierać wyniki badania niezgodności, jej przyczyny oraz planowane działania naprawcze mające na celu zapobieżenie jej ponownemu wystąpieniu. Dowody wdrożenia planu/działań naprawczych należy przedstawić w ciągu trzydziestu (30) dni kalendarzowych od daty zakończenia audytu.
- Czy istnieje różnica w podejściu do audytu przez audytora wewnętrznego i AO?
MDSAP podejściu procesowym. Organ certyfikujący prawdopodobnie będzie analizował powiązania i wątki, podczas gdy audytor wewnętrzny może skupić się bardziej na jednym aspekcie funkcjonalnym naraz. W związku z tym organ certyfikujący może wykryć niezgodność w jednym obszarze funkcjonalnym i szukać odpowiedzi w innym obszarze funkcjonalnym. Jednak stosowanie podejścia procesowego może zakłócać przebieg audytu wewnętrznego.
- Czy mogę odwołać się do AO, jeśli mogę udowodnić, że zarejestrowana niezgodność jest nieważna?
AO ma proces odwoławczy lub sporu, z którego można skorzystać, jeśli można wykazać, że zarejestrowana niezgodność jest nieważna. Jednak oceny przypisane do niezgodności nie mogą zostać zmienione z powodu działań naprawczych. Można je zmienić tylko na podstawie dowodów wskazujących, że nie były one ważne.
- Jak długo ważny jest MDSAP ?
Producenci urządzeń medycznych certyfikowani w ramach MDSAP będą poddawani corocznym audytom zgodnie z trzyletnim cyklem certyfikacji. Pierwszy audyt jest kompleksowym audytem systemu zarządzania jakością producenta urządzeń medycznych. Następnie przez dwa (02) kolejne lata przeprowadzane są coroczne audyty nadzorcze. Cykl rozpoczyna się ponownie od audytu recertyfikacyjnego w trzecim roku.
Aby dowiedzieć się więcej o naszych MDSAP , skontaktuj się Freyr już dziś, aby umówić się na rozmowę z naszymi ekspertami.









