
Imagina que estás trabajando en un nuevo medicamento para tratar una enfermedad devastadora. Tras años de duro trabajo, por fin has recopilado los datos necesarios para presentar una solicitud reglamentaria a la FDA. Pero entonces te das cuenta de que tus registros electrónicos y firmas electrónicas no cumplen con 21 CFR Part 11. Esta es una situación en la que nadie quiere encontrarse. El mundo del cumplimiento normativo es complejo y está en constante evolución. Con la introducción constante de nuevas normativas, puede resultar difícil para las empresas mantenerse al día. Sin embargo, hay una normativa que es esencial para cualquier empresa que opere en un sector regulado: la norma 21 CFR Part 11.
La norma 21 CFR Part 11 establece los criterios para los registros electrónicos y las firmas electrónicas en los sectores FDA. Su objetivo es garantizar que los registros electrónicos sean fiables, seguros y equivalentes a los registros en papel y las firmas manuscritas. La 21 CFR Part 11 relevante para las presentaciones reglamentarias, ya que proporciona orientación para garantizar que los registros electrónicos y las firmas electrónicas cumplan FDA de FDA . Es importante porque las presentaciones reglamentarias suelen contener una cantidad significativa de datos electrónicos, como datos de ensayos clínicos, registros de fabricación y datos de control de calidad.
Estas son algunas de las principales ventajas de cumplir con la norma 21 CFR Part 11 las presentaciones reglamentarias:
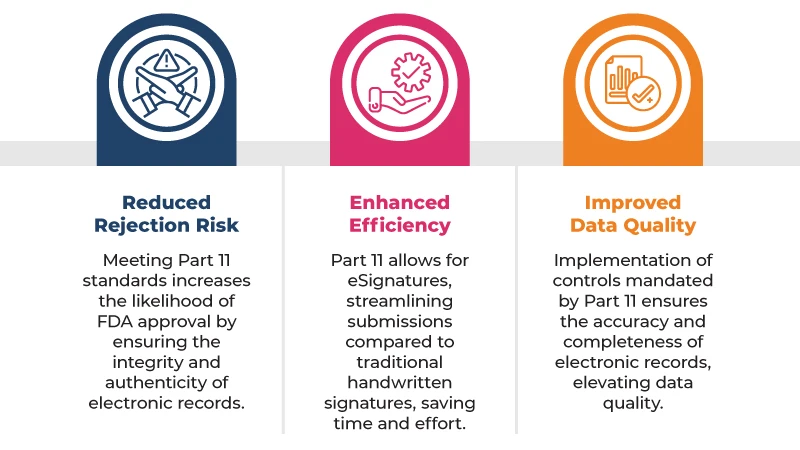
Para cumplir con la 21 CFR Part 11, las empresas deben implementar una serie de controles, entre los que se incluyen:
- Validación de sistemas: Garantizar que los sistemas electrónicos cumplen los requisitos de la Parte 11, incluida una seguridad sólida, registros de auditoría y pruebas de integridad de los datos.
- Controle el acceso de los usuarios: Restringir el acceso al personal autorizado mediante la protección con contraseña, firma electrónica y otros métodos de autenticación.
- Mantener registros de auditoría: Implemente pistas de auditoría para rastrear todos los cambios en los registros, lo que permite la detección e investigación de alteraciones no autorizadas.
- Garantizar la seguridad de los datos: Emplear medidas de seguridad de los datos para salvaguardar los registros electrónicos del acceso, uso, divulgación, alteración, modificación o destrucción no autorizados.
Al cumplir con la norma 21 CFR Part 11, las empresas pueden ayudar a garantizar que sus datos electrónicos de ensayos clínicos sean fiables y dignos de confianza. Esto es importante porque FDA son más propensos a aprobar las solicitudes reglamentarias que contienen datos electrónicos de ensayos clínicos de alta calidad.
21 CFR Part 11 es fundamental para que una presentación a la FDA sea satisfactoria. Y con un software de presentación como Freyr PRO, que centraliza la gestión, mejora la colaboración y garantiza la rapidez de las presentaciones eCTD, además de 21 CFR Part 11 , puede lograrlo. Para obtener más información, solicite una demostración ahora mismo.









