
Tradicionalmente, las tareas de presentación y publicación de documentos reglamentarios han sido laboriosas e implicaban horas de trabajo manual para dar formato a los documentos, generar archivos PDF conformes con las normas de las agencias, realizar comprobaciones de calidad, reunir los documentos para su presentación, etc. Debido a los exigentes plazos, las empresas de ciencias de la vida siempre se apresuran a presentar los documentos a tiempo. En todo el mundo, los organismos reguladores se están preparando para adoptar desarrollos recientes como eCTD v4.0 para la presentación de expedientes, enmiendas y otros informes. eCTD v4.0 es un cambio gradual que probablemente tendrá un impacto en el futuro de las presentaciones reguladoras, y todos los países se están preparando para aceptarlo y aplicarlo.
Teniendo en cuenta todos los retos que plantean las presentaciones reglamentarias, lo que se necesita ahora es una solución tecnológicamente avanzada para impulsar el proceso de presentación y revisión de medicamentos. Dado que las organizaciones ya están considerando que la automatización se convierta en una parte integral del proceso de presentación reglamentaria, es crucial considerar cómo puede mejorar la productividad durante la transición a eCTD 4.0.
¿Cómo ayuda la automatización en la transición al eCTD 4.0?
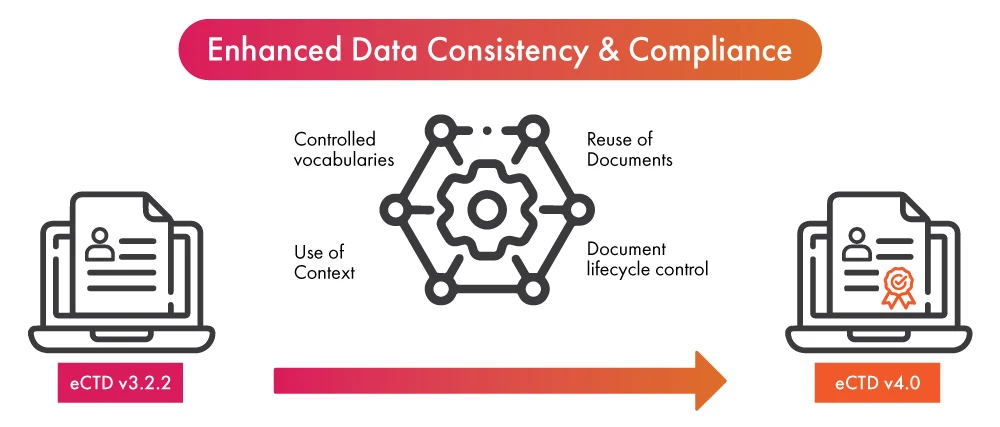
- En vísperas de la adopción de la última versión del eCTD, el despliegue de la automatización en el proceso de presentación reglamentaria puede aportar un doble beneficio a las empresas de ciencias de la vida: por un lado, garantizar el cumplimiento del eCTD v4.0 en menos tiempo y, por otro, mejorar la coherencia de los datos y agilizar el proceso de presentación.
- Una vez que los datos se han finalizado para su uso en una (01) presentación reglamentaria, la automatización hace posible que los datos se incluyan en otras presentaciones o actualizaciones. Aprovecha la nueva función del eCTD v4.0, que ahora permite sustituciones de datos de muchos a uno y de muchos a muchos, permitiendo así la reutilización de los datos de forma simplificada.
- Las notificaciones automatizadas eliminan la necesidad de entregar mensajes o realizar llamadas telefónicas cuando se requiere la actividad. Permite una comunicación más rápida y clara que conduce a vocabularios controlados, un componente esencial de eCTD v4.0.
- La automatización de la presentación de documentos facilitará aún más el proceso de actualización de los contenidos ya presentados. Mejorará el control del ciclo de vida de los documentos presentados.
- La automatización de los grupos contextuales puede agilizar el proceso de organización de múltiples expedientes destinados a la presentación de solicitudes reglamentarias.
En medio de la transición a eCTD v4.0, es fundamental que las organizaciones del sector de las ciencias de la vida se asocien con proveedores que estén preparados para la nueva norma y comprendan cómo automatizar y optimizar el proceso de publicación normativa. Las empresas deben prepararse para adoptar las últimas tecnologías que permite la automatización con el fin de obtener importantes beneficios y una ventaja competitiva en el mercado. eCTD v4.0 es un cambio importante que se ha producido después de mucho tiempo. Las organizaciones deben comenzar su prueba de concepto para tantear el terreno, ya que pronto será aceptado en muchos países de todo el mundo, dependiendo de los plazos de cada país.
En Freyr a la vanguardia de la innovación tecnológica y estamos preparados para ayudar a nuestros clientes con nuestro software de presentación y publicación de documentos reglamentarios:Freyr PRO eCTD v4.0.
Para obtener más información sobre la preparación Freyrpara eCTD 4.0, hagaclic aquí para descargar la sesión archivada del seminario web.









