
Además de completar los envíos xEVMPD requeridos, las organizaciones de ciencias de la vida ahora deberán utilizar un formulario de solicitud basado en la web denominado Digital Application Dataset Integration (DADI). La Agencia Europea de Medicamentos (EMA) diseñó DADI como sustituto a largo plazo del formulario de solicitud electrónico (eAF) en formato PDF, que se creó para dar soporte a los envíos eCTD.
La EMA ha publicado recientemente los plazos para esta transición. DADI sustituirá el formulario para las variaciones de los medicamentos en el año 2022. Otros formularios de presentación para productos autorizados a nivel central (CAP) y productos autorizados a nivel nacional (NAP) le seguirán pronto en 2023. El proyecto también sustituirá los formularios utilizados para los procedimientos clave de la UE, incluidos el procedimiento centralizado (CP), el procedimiento de reconocimiento mutuo (MRP), el procedimiento descentralizado (DCP) y el procedimiento nacional (NP).
Los formularios web (incluido el formulario de variaciones humanas (HVF) para medicamentos destinados al uso humano) uniformizarán los datos introducidos en los eAF para proporcionar datos maestros estándar sobre los medicamentos. Permitirán tanto la salida legible por el ser humano como la nueva salida legible por máquina para el procesamiento digital, basándose en el estándar de intercambio de datos Fast Healthcare Interoperability Resources (FHIR) para medicamentos. También utilizarán los datos maestros de productos existentes de los Servicios de Gestión de Productos (PMS) para rellenar previamente los campos del formulario cuando sea aplicable.
Los formularios web de la DADI tienen por objeto permitir una tramitación más metódica de las solicitudes, reduciendo así la carga de trabajo de la organización. Por ejemplo, se reducirán los errores y discrepancias gracias a que los formularios facilitarán el examen de las solicitudes presentadas por las autoridades sanitarias. Los formularios también facilitarán la introducción de datos "a la primera" en las bases de datos, lo que facilitará la integración de los sistemas y el intercambio de datos entre las autoridades sanitarias. Además, los nuevos formularios sustituirán a la tecnología arcaica.
Ventajas de la DADI
El objetivo de la DADI y de esta transformación de los procesos normativos basada en los datos puede resumirse del siguiente modo:
- Aumentar la eficacia de las funciones de regulación, I+D y fabricación
- Comunicarse con las autoridades sanitarias de forma más rápida
- Facilitar la toma de decisiones basada en datos, tanto para las empresas como para las autoridades.
- Para tener una mejor visión y previsión de los resultados empresariales y del rendimiento global.
Desde un punto de vista holístico, esto pretende ser beneficioso para los pacientes, las autoridades reguladoras y la industria.
Últimos cambios en el calendario de la EMA
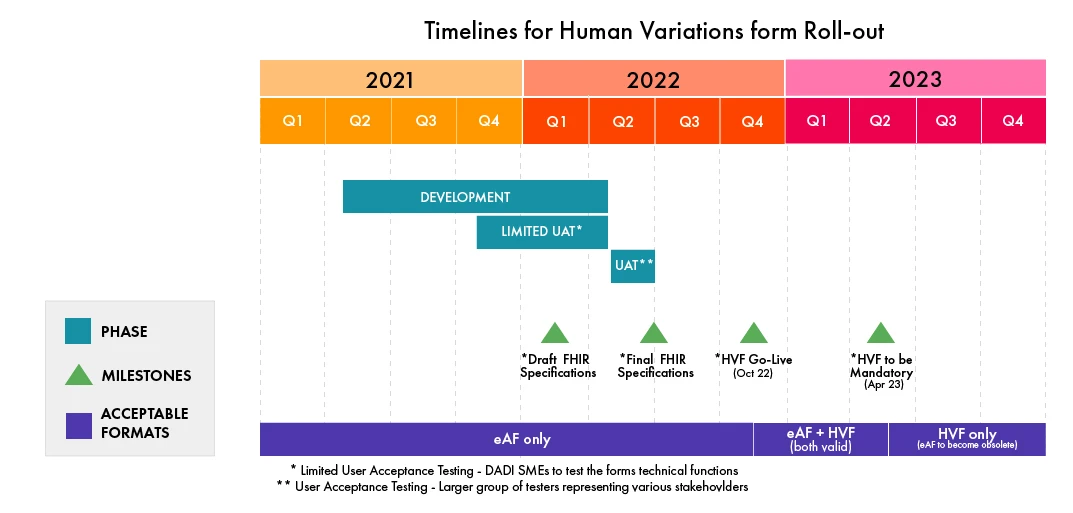
- La fecha de entrada en funcionamiento de las HVF se ha retrasado hasta octubre de 2022, frente a la fecha de abril de 2022 decidida anteriormente.
- Actualmente, el HVF está siendo sometido a pruebas de aceptación de usuarios (UAT) cerradas por un grupo formado por expertos en la materia de la DADI.
- Posteriormente, en el segundo trimestre de 2022, se llevará a cabo una UAT integrada con un grupo más amplio de diversas partes interesadas.
- Una vez que se ponga en marcha, habrá una fase de transición de seis (06) meses en la que se aceptarán de forma paralela tanto los FAE (antigua versión PDF) como los formularios web. Después, sólo se aceptará el formulario HVF.
Consulte la siguiente infografía para conocer los plazos de implementación del HVF (actualizada en febrero de 2022, sujeta a cambios por parte de la EMA):
(fuente: EMA)
Garantizar la adaptabilidad al entorno normativo dinámico
Todas las grandes Autoridades Sanitarias se están orientando hacia la presentación de conjuntos de datos y documentos de alta calidad. Es importante que las organizaciones mantengan lo mismo en un sistema unificado.
También es crucial tener una idea clara de todo el ciclo de vida de la presentación: sus requisitos, las personas y los procesos asociados a ella, y el sitio actual de los datos de origen mediante una evaluación exhaustiva de las necesidades. La limpieza y el enriquecimiento de los datos deben ser prioritarios si la evaluación indica que son necesarios.
Es imprescindible contar con un sistema de gestión de información normativa (RIMS) que se adapte a la evolución de las normativas y directrices, que sea flexible para reestructurar las necesidades actuales de la organización y que cumpla con el dinámico entorno normativo. Para obtener más información sobre el conjunto de soluciones normativas Freyr, que prepararán a su organización para DADI y otros cambios similares en los procesos, us Freyr .









