
La adopción del eCTD 4.0 representa un paso crucial hacia la modernización de las presentaciones reglamentarias en todo el mundo. Con ventajas como la mejora del seguimiento de documentos y la eficiencia metadata, no es de extrañar que las agencias internacionales estén adoptando este cambio.
Pero, ¿cuál es EMA ? A diferencia de la FDA, que ha esbozado fases de implementación claras, EMA adoptando un enfoque más mesurado, comenzando con programas piloto y evaluaciones técnicas. En este blog, desglosamos los planes EMApara el eCTD 4.0, su posible impacto en las presentaciones reglamentarias y cómo su empresa puede mantenerse a la vanguardia.
Y lo que es más importante, ¿ha EMA ya EMA el eCTD 4.0? Profundicemos en el tema.
¿Qué es el eCTD 4.0 y en qué se diferencia del eCTD 3.2.2?
El Documento Técnico Común Electrónico (eCTD) es el formato aceptado internacionalmente para las presentaciones reglamentarias. Estandariza la forma en que las empresas farmacéuticas presentan las solicitudes de medicamentos y gestionan las actualizaciones del ciclo de vida en los distintos mercados.
La versión actual, eCTD 3.2.2, lleva años en uso. Sin embargo, los organismos reguladores, incluida EMA, han estado trabajando en la versión eCTD 4.0, que se basa en el estándar Health Level 7 (HL7) Regulated Product Submission (RPS). Esta actualización mejora la eficiencia de la presentación y la gestión del ciclo de vida normativo.
Principales diferencias entre el eCTD 3.2.2 y el eCTD 4.0:
- Mejor gestión del ciclo de vida: Mejor seguimiento de las versiones de los documentos, lo que reduce la duplicación.
- Granularidad más flexible: Permite la reutilización de documentos estructurados en diferentes presentaciones.
- Mejora en Metadata : metadata más estructurados, lo que facilita las interacciones normativas.
- Mayor interoperabilidad: Diseñado para funcionar mejor con los sistemas reguladores digitales en evolución a nivel mundial.
- Aunque estos cambios ofrecen numerosas ventajas, la transición al eCTD 4.0 requiere preparación, inversión y comprensión de las expectativas normativas.
Postura EMAsobre la adopción del eCTD 4.0
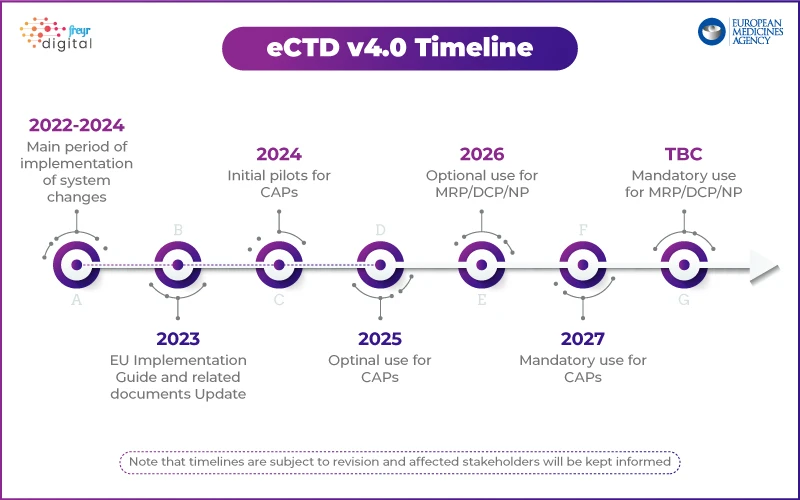
La gran pregunta que todos se hacen es: ¿Ha EMA el eCTD 4.0? La respuesta es que aún no, pero la transición está en marcha.
Situación actual del eCTD 4.0 en la UE:
- Por ahora, eCTD 3.2.2 sigue siendo la norma obligatoria para las presentaciones en la UE.
- EMA estado evaluando activamente el eCTD 4.0, pero no ha exigido oficialmente su uso.
- La agencia está trabajando junto con otros organismos reguladores, como la FDA PMDA de Japón, para armonizar las normas mundiales.
- No se han fijado plazos oficiales para la transición, pero EMA indicado que el eCTD 4.0 acabará siendo obligatorio.
Enfoque EMA: implantación gradual con un programa piloto
A diferencia de la USFDA, que ha esbozado un plan de implementación por fases, EMA adoptando un enfoque estructurado. La agencia ha puesto en marcha un programa piloto técnico para probar la implementación del eCTD 4.0 con las partes interesadas del sector.
Aspectos más destacados de la estrategia eCTD 4.0 EMA:
- Paso 1: Centrarse en la interoperabilidad técnica con las herramientas normativas.
- Fases futuras: Presentaciones simuladas, gestión del ciclo de vida y presentaciones agrupadas.
- Proyecto de paquete de implementación disponible con vocabularios controlados y criterios de validación.
EMA compromete a garantizar una transición fluida, y las empresas del sector de las ciencias de la vida deben seguir las actualizaciones en la página oficial EMA .
Retos y consideraciones para las empresas de ciencias de la vida
Aunque el eCTD 4.0 ofrece claras ventajas, su adopción no está exenta de dificultades. He aquí algunas consideraciones clave para las empresas farmacéuticas y biotecnológicas:
- Complejidades normativas
- La transición gradual EMA significa que las empresas deben estar preparadas para procesos de presentación duales (eCTD 3.2.2 y eCTD 4.0).
- Las distintas regiones tendrán plazos de adopción diferentes, lo que exigirá a las empresas mantenerse ágiles.
- Retos técnicos
- La migración de datos de eCTD 3.2.2 a 4.0 requiere una planificación cuidadosa.
- Las normas de validación cambiarán significativamente, lo que exigirá actualizar el software y las herramientas.
- Las empresas necesitan invertir en automatización y soluciones basadas en IA para garantizar el cumplimiento.
- Riesgos de cumplimiento
- metadata incorrecta metadata o el incumplimiento de los nuevos requisitos de granularidad de los documentos podría dar lugar al rechazo de la presentación.
- Los equipos reguladores necesitan una formación adecuada para comprender las nuevas normas de validación.
- Impacto en los flujos de trabajo existentes
- Las empresas tendrán que adaptar sus procesos internos para dar cabida al eCTD 4.0.
- Será necesaria una mayor colaboración entre los equipos reguladores, informáticos y de presentación.
¿Cuál es la conclusión principal? Las empresas deben empezar a prepararse ahora, aunque EMA aún no EMA hecho obligatorio el eCTD 4.0.
Cómo pueden prepararse las empresas para la transición al formato eCTD 4.0 EMA
Aunque EMA fijado una fecha límite oficial, las empresas proactivas se beneficiarán de una preparación temprana. A continuación explicamos cómo:
- Evaluar los actuales procesos de presentación
- Identificar lagunas en los flujos de trabajo existentes del eCTD 3.2.2.
- Evaluar cómo afectarán las nuevas normas de gestión del ciclo de vida a las presentaciones en curso.
- Invertir en las herramientas eCTD 4.0 adecuadas
- Seleccione un software de presentación reglamentaria compatible con eCTD 4.0.
- Asegúrese de que el software sea compatible con los estándares HL7 RPS y metadata .
- Formar a los equipos de reglamentación e informática
- Organizar talleres y sesiones de formación sobre los cambios del eCTD 4.0.
- Proporcionar directrices para metadata y el seguimiento del ciclo de vida.
- Colabora con EMA otros profesionales del sector.
- Participe en los programas piloto y las consultas normativas EMA.
- Manténgase al día sobre las últimas directrices y actualizaciones normativas EMA.
- Realización de pruebas y validación
- Realice envíos de pruebas internas utilizando estructuras eCTD 4.0.
- Identificar posibles problemas en la granularidad de los documentos y metadata antes del mandato definitivo EMA.
Empezando ahora, las empresas pueden garantizar una transición fluida sin interrupciones en la presentación de la normativa.
¿Cuál es el futuro? Futuro del eCTD 4.0 en Europa
Aunque el calendario completo de la transición sigue sin estar claro, la estrategia a largo plazo EMA incluye:
- Normalización de las presentaciones en todos los mercados mundiales, mejorando la coherencia y la eficacia.
- Reducción de los plazos de aprobación gracias a un mejor seguimiento del ciclo de vida de la presentación.
- Integración de la IA y la automatización en los flujos de trabajo normativos para mejorar el cumplimiento.
En los próximos años, podemos esperar más claridad por parte de EMA, incluyendo plazos oficiales de transición y nuevos criterios de validación.
Conclusión
Aunque EMA aún no EMA impuesto el uso obligatorio del eCTD 4.0, es solo cuestión de tiempo que se convierta en el estándar para las presentaciones reglamentarias en la UE. Las empresas que se preparen de forma proactiva obtendrán una ventaja competitiva, garantizando el cumplimiento normativo y evitando obstáculos reglamentarios de última hora.
Principales conclusiones
- eCTD 3.2.2 sigue siendo la norma actual, pero eCTD 4.0 está en el horizonte.
- EMA adoptando un enfoque gradual, sin un mandato oficial todavía.
- Las empresas deben empezar a prepararse ahora para garantizar una transición fluida.
- La inversión en nuevas tecnologías, la formación de los equipos y las pruebas de presentación serán fundamentales.
Llamamiento a la acción
Manténgase al día con los anuncios normativos EMAy comience a evaluar su preparación para el eCTD 4.0. Cuanto antes se prepare, más fácil será la transición cuando llegue el momento.
¿Necesita ayuda para elegir un software compatible con eCTD 4.0 o para comprender cómo afecta esta transición a su negocio? No dude en reach con us.









