
La Administración de Alimentos y MedicamentosUS EstadosUS FDA) publicó en diciembre de 2022 una guía que revisa la guía titulada «Inexistencia de respuesta a una carta de respuesta ANDA (CRL) de una solicitud abreviada de nuevo fármaco ( ANDA dentro del plazo reglamentario: guía para la industria», de julio de 2022. Su objetivo es orientar a los solicitantes de solicitudes abreviadas de nuevos medicamentos (ANDA) presentadas en virtud del artículo 505(j) de la Ley Federal sobre Alimentos, Medicamentos y Cosméticos (FD&C Act) (21 U.S.C. 355(j)). Una respuesta completa y pertinente a una CRL es fundamental para la aprobación del medicamento genérico. El documento de orientación ofrece recomendaciones sobre las repercusiones de recibir una CRL y las medidas FDA tomar FDA si no se responde a la CRL dentro del plazo especificado.
La FDA garantizar que los medicamentos genéricos aprobados cumplan con los estándares de seguridad, calidad, eficacia y asequibilidad. Si la ANDA los requisitos FDA , se envía una CRL al solicitante, en la que se incluyen las deficiencias identificadas durante su evaluación.
A continuación se describe de forma figurativa lo que puede hacer un solicitante en el plazo de un año tras recibir el LCR:
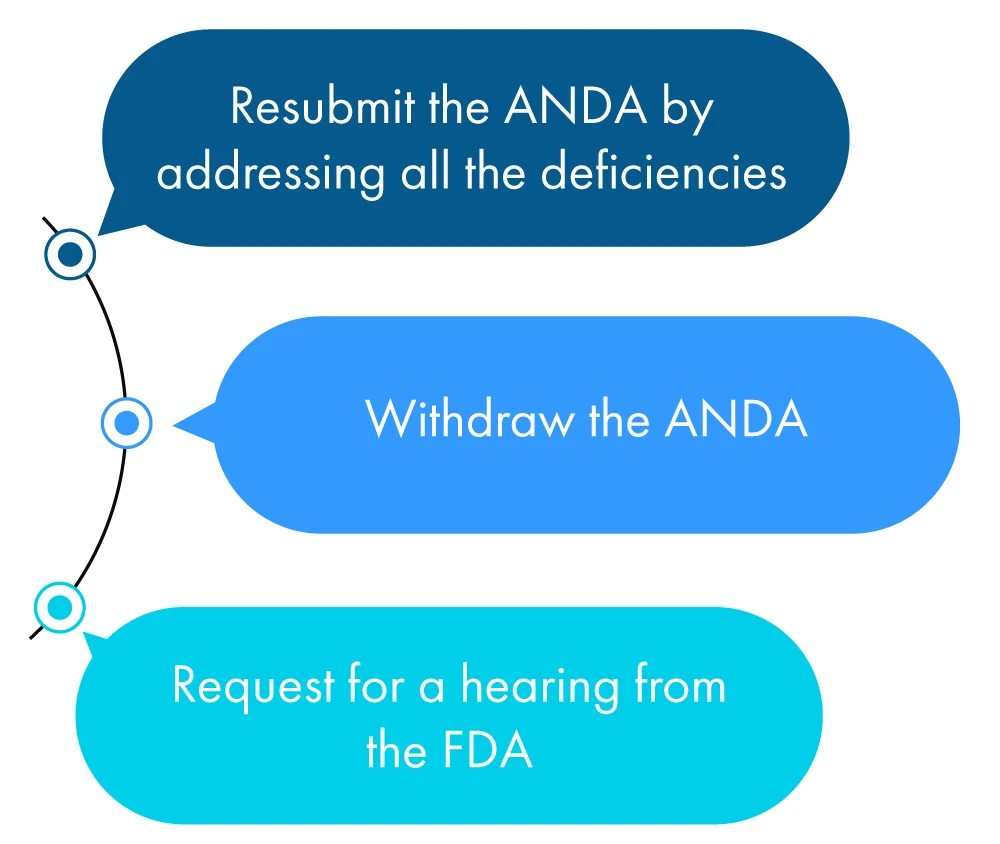
Si el solicitante no realiza ninguna de las acciones anteriores, la FDA que se trata de una solicitud de retirada de la ANDA el solicitante haya solicitado una prórroga para comprobar todas las discrepancias mencionadas en la CRL.
¿Qué ocurre transcurrido un (01) año desde la expedición del LCR?
La FDA una notificación por escrito indicando que el solicitante dispone de treinta (30) días a partir de la notificación para lo siguiente:
- Exponer las razones por las que no ANDA retirarse la ANDA
- Solicitud de prórroga para subsanar todas las deficiencias mencionadas en el LCR
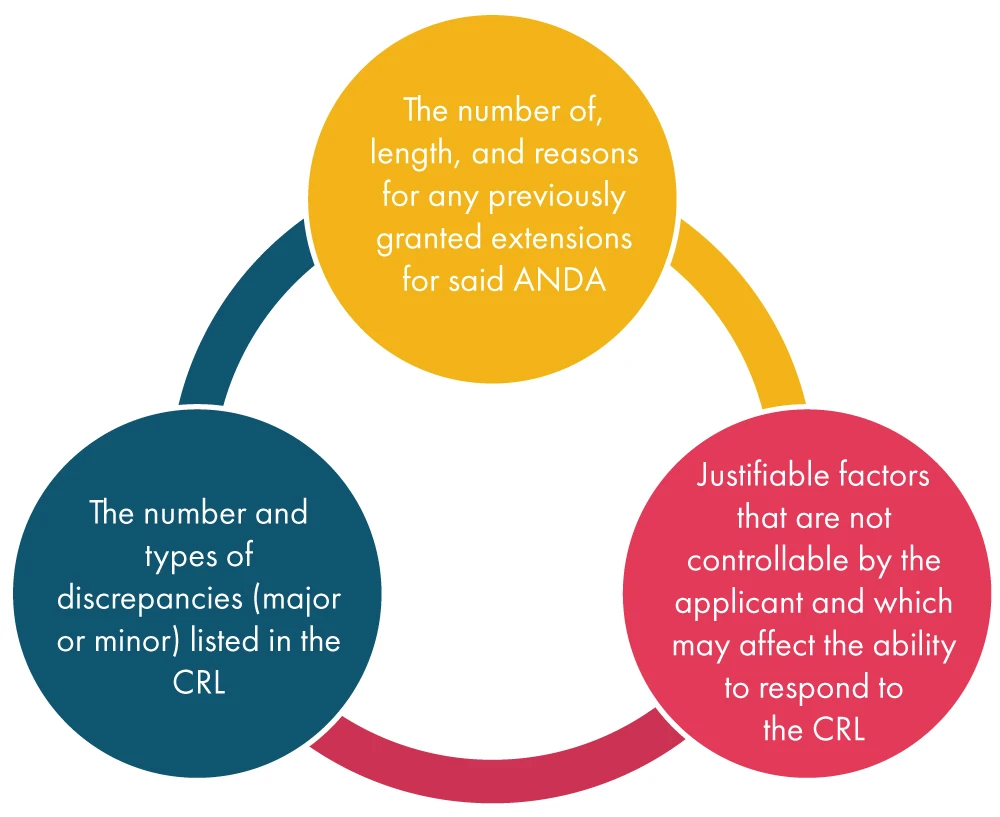
Una vez que la FDA una solicitud de prórroga del solicitante, tiene en cuenta diversos factores, tal y como se menciona a continuación, y posteriormente decide sobre la solicitud:
¿Qué es una enmienda?
El solicitante debe presentar una solicitud de prórroga para responder a una CRL mediante una enmienda. La FDA las enmiendas como importantes o menores en función del efecto que tienen en el proceso de aprobación.
FDA importantes FDA que los solicitantes deben tener en cuenta:
- La FDA una enmienda menor como mayor si la enmienda se presenta después de un año de la CRL, a menos que la ANDA para un producto que figure en la lista de escasez de medicamentos según la sección 506E de la Ley FD&C (21 U.S.C. 356e), o sea objeto de una respuesta a una emergencia de salud pública declarada por el Secretario del US de Salud y Servicios Humanos US en virtud del artículo 319 de la Ley de Servicios de Salud Pública (42 U.S.C. 247d), o se prevea que esté sujeta a los mismos criterios que se aplican a dicha declaración en el momento de la presentación.
- Si el solicitante no subsana las discrepancias indicadas en la CRL dentro del plazo ampliado concedido por la FDA, esta última podrá considerar la retirada de la ANDA.
- Si el solicitante necesita más de treinta (30) días de prórroga, puede solicitar una prórroga adicional. La enmienda deberá incluir nueva información que permita FDA la FDA si se puede conceder la prórroga o no.
Obtener una CRL de la FDA resultar bastante abrumador para ANDA . Desde abordar las discrepancias hasta citar las razones o la información correctas para una prórroga, se deben cumplir todos los requisitos pertinentes para garantizar una aprobación más rápida del medicamento. Freyr es un experto regulador de probada solvencia con amplios conocimientos en la respuesta a CRL y en garantizar el cumplimiento de FDA . Póngase en contacto con nosotros ahora para obtener apoyo end-to-end en ANDA .









