
El mundo de la normativa farmacéutica está a punto de recibir una importante actualización con la implantación del eCTD 4.0. Este formato estandarizado promete un viaje más fluido para las solicitudes de nuevos medicamentos presentadas a los organismos reguladores. Pero para las empresas que quieren hacerse un hueco en el mercado farmacéutico japonés de 141.500 millones de dólares, hay un giro crucial: ¡Japón está acelerando el plazo de adopción!
A continuación se analizan estos aspectos destacados:
- Adopción obligatoria: Al contrario de lo que ocurre en otros ámbitos, que tienen fases voluntarias antes de la adopción obligatoria, para 2026 Japón pretende que el uso del eCTD 4.0 sea obligatorio.
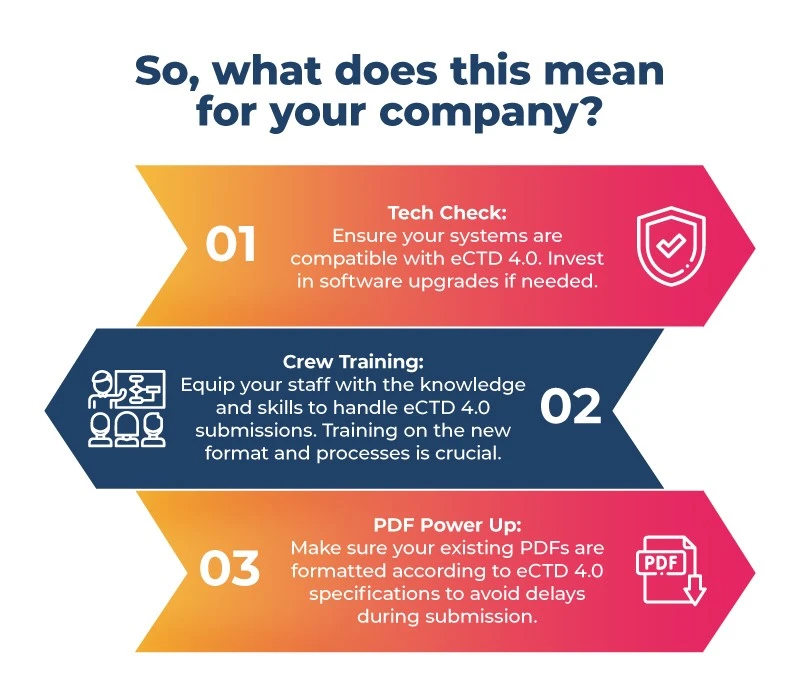
- La preparación es clave: La preparación es clave debido a las limitaciones de tiempo y a la ausencia de una ruta de migración directa PMDA JP1.0 PMDA japonesa al eCTD 4.0. Centrarse en un sistema mejor ayudará a las empresas farmacéuticas japonesas durante el proceso de transición. Estos pasos incluyen la actualización del software, la formación del personal y la preparación de archivos PDF para el nuevo formato.
- Recursos disponibles: La Agencia de Productos Farmacéuticos y Dispositivos Médicos (PMDA) de Japón ha publicado recursos que pueden servir de guía a las empresas para afrontar este cambio, como la «Guía de implementación del documento técnico comúnICH eCTD 4.0ICH », con explicaciones sobre los cambios introducidos y las mejores prácticas disponibles.
He aquí algunas razones por las que no debe perderse este juego de números:
- Vía rápida hacia el eCTD 4.0: a diferencia de otras regiones, donde el proceso se lleva a cabo por fases, Japón tiene como objetivo la adopción obligatoria del eCTD 4.0 ya en 2026. ¡Eso es tres años antes de la fecha límite fijada porFDA US FDA 2029! Con un calendario tan agresivo, Japón se ha situado a la vanguardia en lo que respecta a la incorporación global del eCTD.
- Sin margen de error: JP no puede convertirse directamente a eCTD 4.0, a diferencia de sus versiones anteriores. Esto significa que las empresas farmacéuticas tienen que estar muy preparadas para evitar retrasos en la presentación que puedan costarles millones en ingresos.
- Una mano amiga para un aterrizaje suave: La Agencia de Productos Farmacéuticos y Dispositivos Médicos (PMDA) de Japón comprende los retos. Ha elaborado recursos como guías de implementación diseñadas para orientar a las empresas a través de estas modificaciones con facilidad y aterrizar bien en el mercado japonés. (pmda).
Si está desarrollando medicamentos para el enorme mercado japonés, ¡es hora de abrocharse el cinturón! Esta es su lista de comprobación previa al vuelo:
La transición a eCTD 4.0 promete una mayor eficiencia y estandarización global en todo el proceso de aprobación de medicamentos. Su empresa puede anticiparse a este cambio en Japón para lograr una transición fluida y aprovechar las innumerables oportunidades que ofrece esta nueva era. Recuerde que no prepararse es prepararse para fracasar, así que esté listo para despegar con eCTD 4.0 en Japón.
Las ventajas y oportunidades que ofrece son muy atractivas para la industria farmacéutica. Sin embargo, también presenta una serie de dificultades que deben resolverse. Para navegar sin problemas por un entorno normativo en constante cambio, las empresas pueden buscar asociaciones con consultores fiables como Freyr. Aproveche el futuro de las presentaciones reglamentarias en Japón con nuestro incomparable software eCTD, Freyr SUBMIT PRO, que cumple con 21 CFR Part 11 y tiene un modelo de implementación flexible. Póngase en contacto con us para obtener más información y emprender un viaje hacia una mayor eficiencia y éxito. Solicite una demostración hoy mismo.









