Los radiofármacos son medicamentos que contienen radioisótopos y se utilizan como agentes diagnósticos y terapéuticos. Actúan sobre órganos, tejidos o células específicos del cuerpo humano. Estos productos medicinales pueden administrarse por vía oral, intravenosa o intersticial, y constituyen una subespecialidad de la radioterapia. Existen normas estrictas para la comercialización de radiofármacos, ya que solo pueden ser administrados por profesionales especializados en medicina nuclear. Sin embargo, las oportunidades son inmensas debido a su capacidad para diagnosticar ciertos problemas médicos o tratar enfermedades como el cáncer. El mercado mundial de radiofármacos alcanzó aproximadamente US millones US en 2022, y se espera que reach US 930 millonesUS en 2030, con una tasa de crecimiento anual compuesta (CAGR) del 11,76 %.
Las empresas farmacéuticas de todo el mundo están tratando de hacerse con su cuota del mercado de los radiofármacos, incluidas las de Canadá. Health Canada HC), la Health Authority (HA) canadiense Health Authority (HA) es conocida por sus esfuerzos para poner a disposición del público servicios sanitarios de alta calidad. Existen directrices y normativas estrictas para garantizar la seguridad de los pacientes ante todo. Los fabricantes y patrocinadores que deseen entrar en el mercado canadiense de radiofármacos deben comprender las normativas establecidas por HC y diseñar en consecuencia la estrategia de presentación ideal para obtener una aprobación más rápida en el mercado.
Hoja de ruta reglamentaria para la presentación de radiofármacos en Canadá
Todos los medicamentos comercializados en Canadá deben cumplir con la Ley de Alimentos y Medicamentos (FDA) y el Reglamento de Alimentos y Medicamentos (FDR). Los radiofármacos figuran en el Anexo C de la FDA. La Dirección de Productos Biológicos y Terapias Genéticas (BGTD) del Ministerio de Salud regula la autorización de comercialización de estos productos. Se aprueban para uso humano tras una evaluación satisfactoria de la seguridad, eficacia y calidad de los radiofármacos presentados.
HC es miembro oficial del Consejo Internacional para la Armonización de los Requisitos Técnicos para Productos Farmacéuticos de Uso Humano (ICH). Ha adoptado los ICH relacionados con la calidad, la seguridad, la eficacia y temas multidisciplinarios. La lista de estos documentos está disponible en el sitio web de HC para referencia de los patrocinadores.
Además de los documentos mencionados anteriormente, la Guía para la industria: Gestión de solicitudes de medicamentos (documento de orientación), cuya última actualización data del 2 de agosto de 2022, us la perspectiva de HC a la hora de evaluar la información presentada por los patrocinadores sobre radiofármacos. El siguiente gráfico (Figura 1) ofrece una visión general de los temas tratados en el documento de orientación.
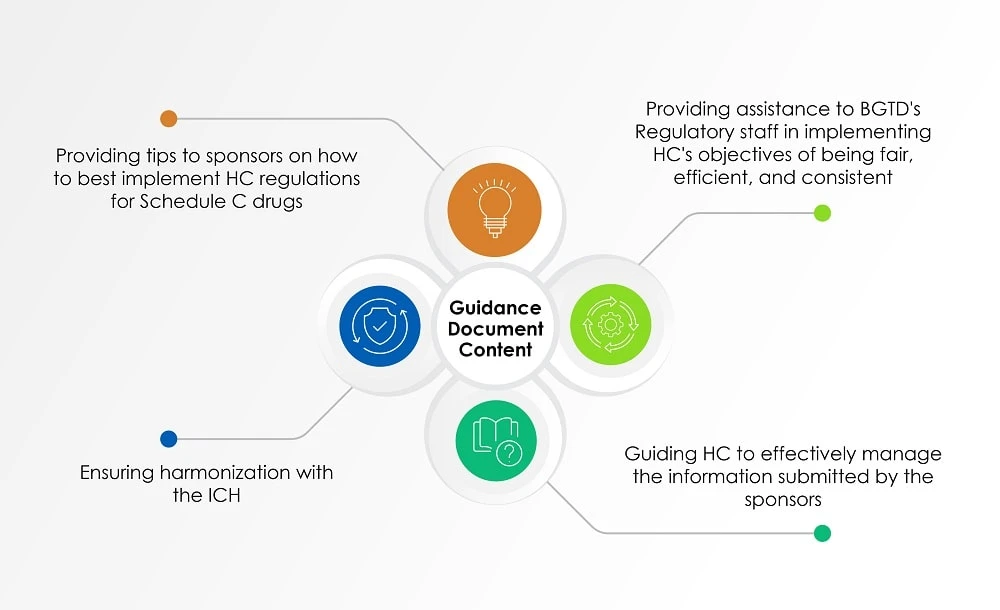
Figura 1: Contenido de un documento de orientación
Los requisitos reglamentarios para los medicamentos de la Lista C son los mismos que para otros medicamentos. Los requisitos incluyen presentaciones y seguir el proceso para obtener la autorización de comercialización. Sin embargo, los requisitos de presentación de datos son diferentes de los de otros medicamentos debido a sus propiedades específicas.
NDS
El fabricante/patrocinador del medicamento debe presentar al BGTD una solicitud de nuevo medicamento (NDS), que debe contener los siguientes datos:
- Información sobre la seguridad, calidad y eficacia del medicamento.
- Informes/resultados de ensayos preclínicos y clínicos.
- Información sobre la fabricación del medicamento.
- Indicaciones de etiquetado y envasado.
- Declaraciones terapéuticas y posibles efectos secundarios del medicamento.
El promotor puede hacer una presentación ante el BGTD antes de presentar la NDS. Esta reunión previa a la presentación es beneficiosa, ya que el promotor puede abordar cualquier laguna/pregunta planteada por el BGTD y asegurarse de que la presentación contiene toda la información requerida. Lo ideal es que la reunión tenga lugar tres (03) meses antes de la fecha límite de presentación.
Los promotores también pueden considerar vías de revisión alternativas, como una Revisión Prioritaria o una Notificación de Cumplimiento de Condiciones (NOC/c). A continuación se ofrece un resumen de ambas vías:
- Revisión prioritaria: Esta vía se aplica a una NDS o Suplemento a una Presentación de Nuevo Medicamento (SNDS) para una enfermedad/afección potencialmente mortal o gravemente incapacitante para la que existan pruebas suficientes de la eficacia del medicamento en términos de diagnóstico, tratamiento o prevención de dicha afección. También es aplicable cuando existe un aumento sustancial de la eficacia y/o una disminución considerable del riesgo para una enfermedad que no cuenta con un medicamento eficaz en el mercado canadiense.
- NOC/c: Esta vía considera la evaluación riesgo-beneficio de un medicamento. El NOC/c es para un fármaco que tiene un perfil de seguridad aceptable para una enfermedad o afección potencialmente mortal o gravemente incapacitante. La autorización se concede con pruebas favorables para el radiofármaco. Esta vía se aplica a NDS, SNDS y a la presentación abreviada de nuevos medicamentos (ANDS).
El formato NDS
HC ha adoptado el formato de documento técnico común electrónico (eCTD) para la presentación de medicamentos radiofarmacéuticos. De hecho, se han creado plantillas separadas de resúmenes de información de calidad, como QIS-R y QIS-PER, para las presentaciones de radiofármacos.
Conclusión
Mientras que la HC regula la autorización de comercialización de radiofármacos basándose en la evaluación satisfactoria de la seguridad, eficacia y calidad de las presentaciones, la Comisión Canadiense de Seguridad Nuclear (CNSC) regula la seguridad radiológica de los radiofármacos. La CNSC controla aspectos como la manipulación, el envasado, el etiquetado, el almacenamiento, la eliminación, etc., de los materiales radiactivos. También establece normas para los equipos utilizados en la fabricación de medicamentos radiofarmacéuticos.
El cumplimiento de las normativas vigentes de HC y CNSC es esencial para la evaluación satisfactoria de las solicitudes de medicamentos radiofarmacéuticos. Asóciese con un experto en normativa de probada solvencia como Freyr llevar a cabo actividades de publicación y presentación sin errores y sin contratiempos en Canadá. ¡Manténgase informado! ¡Cumpla con la normativa!









