
El Sistema de Información sobre Ensayos Clínicos (CTIS) es una base de datos centralizada que respalda la realización de ensayos clínicos en la Unión Europea (UE). Se puso en marcha en enero de 2022 y es un componente clave del Reglamento sobre ensayos clínicos (CTR), cuyo objetivo es mejorar la eficiencia y la transparencia de los ensayos clínicos en la UE. El CTIS una serie de características que lo convierten en una herramienta valiosa para los patrocinadores de ensayos clínicos, los investigadores y las autoridades reguladoras.
Estas características incluyen:
- Un único punto de entrada para presentar y gestionar ensayos clínicos en varios países.
- Una forma segura y eficaz de intercambiar información entre patrocinadores, investigadores y organismos reguladores.
- Una base de datos de ensayos clínicos accesible al público.
- Herramientas de apoyo al seguimiento y la supervisión de los ensayos clínicos.
- CTIS ya CTIS teniendo un impacto positivo en el panorama de los ensayos clínicos en la UE. Facilita y agiliza la realización de ensayos clínicos y garantiza que los datos de los ensayos clínicos sean más transparentes y accesibles.
Explore CTIS para sus ensayos clínicos
Optimice ya sus ensayos clínicos
Cómo CTIS cambiando el panorama de los ensayos clínicos:
- CTIS facilitando la realización de ensayos clínicos en varios países:
Anteriormente, los patrocinadores tenían que presentar solicitudes por separado en cada país en el que deseaban realizar un ensayo clínico. Se trataba de un proceso largo y costoso. CTIS los patrocinadores presentar una única solicitud válida en todos Member States de la UE. Esto facilitó y agilizó considerablemente la realización de ensayos clínicos en varios países por parte de los patrocinadores.
- CTIS mejorando la eficiencia del proceso de revisión de ensayos clínicos:
Los organismos reguladores de diferentes países ahora pueden colaborar más fácilmente a través CTIS. Esto significa que ahora se pueden revisar de forma más rápida y eficiente.
- CTIS aumentando la transparencia de los datos de los ensayos clínicos:
El sitio web público del CTIS acceso a información sobre todos los ensayos clínicos registrados en el sistema. Esta información incluye el protocolo del ensayo, los resultados del mismo y cualquier cuestión relacionada con la seguridad. Esta mayor transparencia está contribuyendo a fomentar la confianza del público en los ensayos clínicos.
CTIS una herramienta valiosa que ayuda a abordar algunos de los principales retos que se plantean durante los ensayos clínicos. Al facilitar, agilizar y hacer más transparente la realización de ensayos clínicos, CTIS llevar rápidamente nuevos tratamientos a los pacientes.
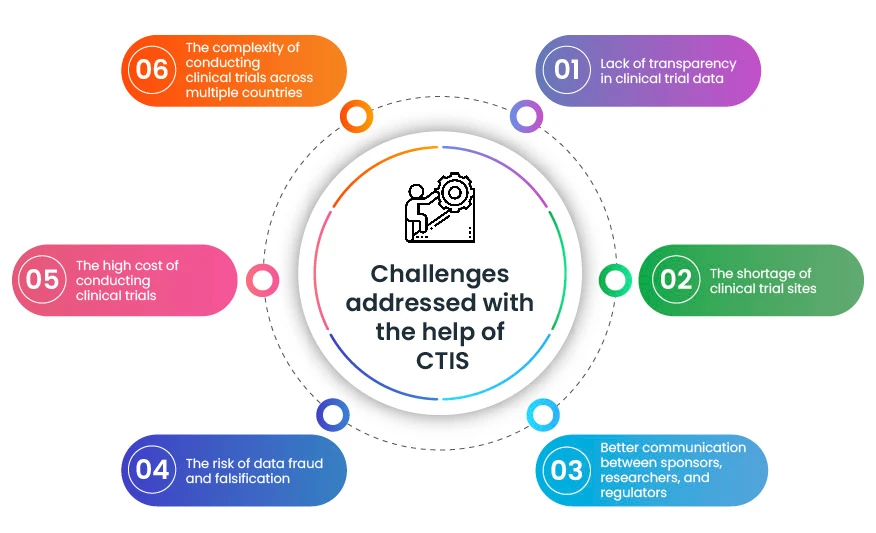
CTIS todavía un sistema relativamente nuevo, pero tiene el potencial de revolucionar la forma en que se llevan a cabo los ensayos clínicos en la UE. En un mundo en el que los avances científicos son más importantes que nunca, CTIS, en sinergia con un socio regulador global como Freyr, es la clave para abrir nuevas fronteras en el ámbito de la asistencia sanitaria. Al adoptar estas tecnologías transformadoras, allanamos el camino para descubrimientos más rápidos, seguros e impactantes que tienen el potencial de dar forma al futuro de la medicina para las generaciones venideras.









